下列反应不属于氧化还原反应的是( )
| A.2Na2O2+2CO2 |
B.Ca(O H)2+2NH4Cl CaCl2+2NH3↑+2H2O CaCl2+2NH3↑+2H2O |
C.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
D.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
下列叙述错误的是
| A. | Ca(ClO) 2溶液暴露于空气中,一段时间后其pH变小 |
| B. | 向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收 |
| C. | 第ⅥA族元素的氢化物中,稳定性最强的其沸点最高 |
| D. | 共价键、离子键、范德华力和氢键是形成晶体的四种作用力,这四种力不可能同时存在于同一晶体中 |
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
 |
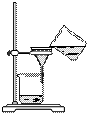 |
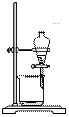 |
 |
|
|
在298K、101kPa时,已知:H2O(g) ="==" H2O(l);△H1
C2H5OH(g) ="==" C2H5OH(l);△H2
C2H5OH(g)+3O2(g) ="==" 2CO2(g)+3H2O(g);△H3
则酒精的燃烧热△H =
A.△H1+△H2+2△H3
B.△H1—△H2+△H3
C.3△H1+△H2+△H3 D.3△H1—△H2+△H3
D.3△H1—△H2+△H3
在碱性条件下能够大量共存,而在强酸性条件下却能发生氧化还原反应的离子组是
| A.Ca2+、AlO2-、SO42-、Cl- |
| B.K+、Na+、ClO-、Cl- |
| C.Na+、Fe2+、NO3-、SO42- |
| D.NH4+、Na+、F-、CO32- |
2010年世界博览会已于2010 年5月1日至10月31日在中国上海举行。为了贯彻生态、环保、绿色世博的理念,下列措施中不合理的是
| A.在世博园区进行大规模绿化建设,提高绿化面积w |
| B.建立空调凝结水和屋面雨水收集系统,充分利用水资源 |
| C.将世博园区的垃圾收集起来进行集中焚烧或深埋处理 |
| D.在建筑、布展、运营过程中应用大规模的太阳能光伏发电系统 |