某课外活动小组利用如下左图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白: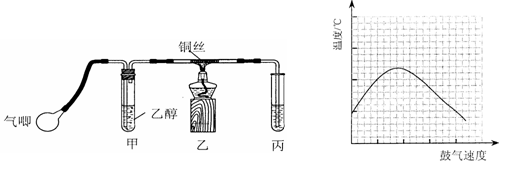
(1)检验乙醛的试剂是 ;
| A.银氨溶液 | B.碳酸氢钠溶液 | C.新制氢氧化铜悬浊液 | D.氧化铜 |
(2)乙醇发生催化氧化的化学反应方程式为 ;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 ___ ,由于装置设计上的缺陷,实验进行时可能会 _____ 。
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如上右图所示。
试解释鼓气速度过快,反应体系温度反而下降的原因: ,该实验中“鼓气速度”这一变量你认为可用 来估量;
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是:
(2)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法:
(3)经检验上 述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(结合化学方程式说明):
述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(结合化学方程式说明):
(4)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是:
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有人设计如下图所
示的装置: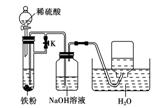
请简述实验操作及原理:
(1)用一种 试剂鉴别下列各组物质:
试剂鉴别下列各组物质:
① 鉴别Fe、FeO、CuO、FeS、MnO2、活性碳等黑色物质,试剂是
鉴别Fe、FeO、CuO、FeS、MnO2、活性碳等黑色物质,试剂是
②鉴别FeSO4、(NH4)2SO4、AlCl3、MgCl2、KNO3等五种溶液,试剂是
③鉴别K2S、AgNO3、NH4SCN、KBr、NaI等五种无色溶液,试剂是
(2)实验室里常用的干燥剂有:①浓硫酸(98%),②无水氯化钙,③变色硅胶[硅胶的主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂,无水氯化钴呈蓝色,吸水后变为CoCl2·6H2O呈粉红色],④五氧化二磷,⑤碱石灰(主要成分是氢氧化钠、氧化钙,制法是:把生石灰加到浓的烧碱溶液中,再加强热蒸干),等等。
a、写出制取干燥剂碱石灰过程中有关反应的化学方程式。
b、上述物质中,属于纯净物的是
| A.①②④ | B.②④ | C.①②④⑤ | D.全部 |
c、上述干燥剂中,不宜用于干燥氯化氢气体的是
d、上述①~④,其主要化学成分依次属于
(填写各物质所属的类别)。
实验室用碳酸钠晶体(Na2CO3•10H2O)配制1.00 mol/L的Na2CO3溶液240mL,回答下列问题:
(1)所需主要仪器为:药匙、托盘天平、烧杯、量筒、、
和胶头滴管;
(2)本实验须称量碳酸钠晶体(Na2CO3•10H2O)g。
(3)容量瓶上标有刻度线、、。
(4)试分析下列操作,对所配溶液的浓度有何影响。
①若定容时俯视读数,会导致所配溶液浓度。
②若用未经干燥的容量瓶去配制溶液,会导致所配溶液浓度。
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
| ①分别取等体积的2 mol/L 硫酸于试管中; ②分别投入大小、  形状相同 形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
该同学的实验目的是研究 对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持
对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持 条件相同。
条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。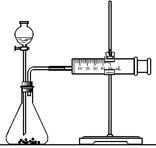
完成该实验应选用的实验药品是
;应该测定的实验数据是。
已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO 4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。
4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。
(已知: (NH4)2SO4+FeSO4+ 6H2O (NH4)2SO4•FeSO4•6H2O↓)根据下图回答:
(NH4)2SO4•FeSO4•6H2O↓)根据下图回答: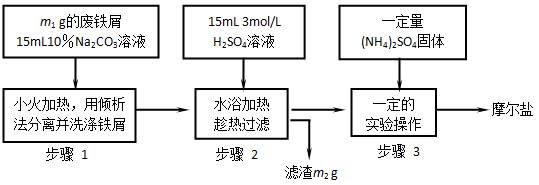
(1)步骤1中Na2CO3的主要作用是。
(2)步骤2中铁屑过量的目的是(用离子方程式表示):。步骤2中溶液趁热过滤的原因是。
(3)步骤3中,加入(NH4)2SO4固体后,应加热到溶液表 面出现晶膜时,停止加热。为什么不能蒸干?。需经过的实验操作包括:、 、减压过滤(或抽滤)等得到较为干燥
面出现晶膜时,停止加热。为什么不能蒸干?。需经过的实验操作包括:、 、减压过滤(或抽滤)等得到较为干燥
的晶体。步骤3中制得的晶体要用无水乙醇洗涤的目的是。
(4)摩尔盐产品中离子的检验:
甲同学提出可以用湿润的试纸、稀盐酸和溶液检验出这三种离子。
乙同学提出检验产品中的Fe2+,可以用KSCN溶液和另一种试剂来检验,试简述乙同学操作和现象:。
(5)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积10.00 mL。
①本实验的指示剂。
| A.酚酞 | B.甲基橙 | C.石蕊 | D.不需要 |
②KMnO4溶液置于(酸式、碱式)滴定管中
③产品中Fe2+的质量分数为。