9分)常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:4Fe(OH)2+ O2+ 2H2O = 4Fe(OH)3 (红褐色固体)Fe(OH)2读作 ;此反应的基本类型是 。
某同学用食品脱氧剂(2g铁粉、0.5g活性炭、0.5g食盐)进行如下两个实验:
实验Ⅰ:
请回答:①操作Ⅰ的名称是 ,
②溶液丙中含有的阳离子是 (写微粒符号)
实验Ⅱ:将乙洗涤烘干后,二氧化碳通过灼热的乙生成丁。
进行如下实验,物质之间的转化关系如下图(部分产物略去)。
①金属A与B的活动性:A B(填“﹥”“﹤”或“﹦”);
②区别有色溶液C与有色溶液D的方法是
;
③反应①③的化学方程式为: , ,
④向溶液C中加入BaCl2溶液,有白色沉淀产生。其化学方程式为 。
(9分 )下面是实验室制取和收集气体的装置,请按要求作答:
)下面是实验室制取和收集气体的装置,请按要求作答:
(1)仪器a的名称是▲ 。
。
(2)用B装置制取气体并能随时停止反应,上部与下部对接应选▲(填“b”、“c”)。
(3)从装置A-D中选择:加热KMnO4制取O2并用排水法收集,应选用图中的▲和
▲(填字母),反应的化学方程式为▲;实验室制取CO2应选的发生装置用 图中的▲(填字母)。
图中的▲(填字母)。
(4)用装置E排空气收集H2,气体应从导管的▲(填“d”、“e”)端进入;由于氧气具有▲ 的性质,可将F装置导管补全后排水收集。
的性质,可将F装置导管补全后排水收集。
(5)若在E装置中加入浓硫酸,用E、C两装置收集干燥的二氧化碳,则气体应由E装置导管的▲(填“d”、“e”)端进。
孔雀石主要含Cu2(OH)2CO3〔也可认为是Cu(OH)2·CuCO3〕,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O,步骤如下:
|
请回答下列问题:(1)气体E的化学式是 。
(2)由溶液C获得CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、 和干燥等操作。金属镁可与热水反应生成一种碱和一种气体。某同学将镁条放在热水中煮沸,趁热取出部分溶液,滴加酚酞试液,溶液变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。请根据以上信息回答:
(1)同学们根据质量守恒定律,对生成的气体进行了两种推测:推测一:该气体是氢气;推测二:该气体是氧气。请选择上述任意一种推测进行实验验证。
| 实验步骤 |
实验现象 |
实验结论 |
(2)反应后溶液滴加酚酞试液变红色,说明;
(3)请你对放置一段时间后溶液红色褪去这种现象进行探究。(只要提出假设、方案,不需要说出方案实施的具体结果)
假设一: 热的Mg(OH) 2溶液与空气的CO2反应,生成盐,溶液褪色。
方案一:向热的Mg(OH)2溶液中滴加酚酞试液,再通入CO2,观察溶液颜色变化。
假设二:_____________________________。方案二:_____________________________。
(10分,每空2分)现要制取一些二氧化氮气体来做演示分子运动的实验。已知二氧化氮气体可以
通过铜和浓硝酸反应得到,其化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。二氧化氮是一种红棕色的气体,密度比空气大,能和水反应生成HNO3和NO气体,NO则为一种无色气体,难溶于水,一遇到O2就会变成NO2,NO和NO2都是大气污染物。现给出下列装置(A~G),请回答有关问题: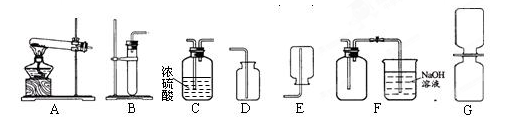
(1)制取一瓶干燥的二氧化氮气体时,所选择的装置依次为 (填序号);
(2)收集NO气体时应用_________________法;
(3)写出二氧化氮和水反应的化学方程式 ;
(4))用如上图G装置演示分子运动时,为了缩短演示的时间,NO2最好放在_________(选填“上”或“下”)面的集气瓶中,另一瓶是空气,抽去两瓶之间的玻璃片,可以观察到的现象是: 。
小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动。
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液。铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液。
【预测】三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu②Al Cr Cu③Al Cu Cr
【实验过程】取大小相同的三种金属薄片,用砂纸打磨光亮。
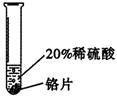
| 实验一 |
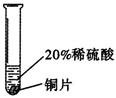
实验二 |
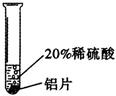
实验三 |
|
| 实验 方案 |
 |
 |
 |
| 实验 现象 |
铬片表面产生气泡缓慢,溶液变蓝色。 |
_____________________ |
铝片表面产生气泡较快。 |
| 结论 |
铬能和稀硫酸发生反应,反应速率较慢。 |
铜不与稀硫酸反应 |
_____________________ |
| 三种金属在金属活动性顺序中的相对位置关系是___________________ |
【回答问题】
(1)用砂纸打磨金属片的目的是_____________________。
(2)实验一所发生反应的化学方程式是____________________________。
(3)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是__________________。
(4)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是________________。
【归纳】比较金属活动性强弱的方法有:
①_______________________________ ;②___________________________________。