某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
| 实验 编号 |
温度/K |
盐酸浓度 /mol·L-1 |
醋酸浓度/mol·L-1 |
实验目的 |
| ① |
298 |
0.20 |
|
a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
| ② |
308 |
0.20 |
|
|
| ③ |
298 |
0.40 |
|
|
| ④ |
|
0.20 |
0.20 |
|
| ⑤ |
|
|
|
(1)请完成上工作表(填写实验④⑤的空格)。
(2)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系如图: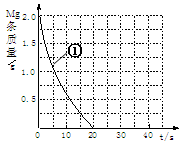
Ⅰ假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是 。
Ⅱ若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
(12分)甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量Na2O)的纯度。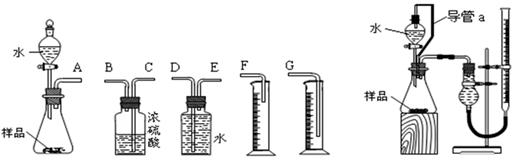
(1)甲组同学拟选用左图实验装置完成实验:
①写出实验中所发生反应的化学方程式_____________________________________________
②该组同学必须选用的装置的连接顺序是:A接()()接()()接()(填接口字母,可不填满。)
③实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其旋塞,一会儿后水也不能顺利滴入锥形瓶。请你帮助分析原因: _____________________________________ __。
④实验结束时,该组同学应怎样测量实验中生成的氧气的体积?。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是:____________________________、_________。
②若实验中样品的质量为wg,实验前后碱式滴定管中液面读数分别为V1、V2 (换算成标况)。则样品的纯度为____________________________(含w、V的表达式)。
实验室配制500 mL 0.1 mol·L-1的Na2CO3溶液,请回答下列问题。
(1)应用托盘天平称取Na2CO3·10H2O晶体g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1 g以下用游码),天平平衡时,则实际称量的Na2CO3·10H2O晶体g。
(3)用托盘天平和小烧杯称出Na2CO3·10H2O的质量,其正确操作顺序的标号为(操作可以重复)_______________。
| A.调整零点 |
| B.将游码移至刻度尺的零刻度处,将砝码放回砝码盒内 |
| C.将碳酸钠晶体放入小烧杯中称量 |
| D.称量空的小烧杯 |
E.记录称量结果
(4)下列操作对配得的溶液无影响的是(填序号);会使所配溶液浓度偏大的是(填序号)。
①在烧杯内溶解溶质,搅拌时不慎溅出少量溶液。
②容量瓶未烘干就用来配制溶液。
③定容时俯视刻度线。
④定容时仰视刻度线。
⑤定容时不小心使少量蒸馏水流出瓶外。
⑥将所配溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出。
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-.将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是________.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol/L) |
(3)试确定K+是否存在?________,判断的理由是________________________________
某实验需要用1.0mol·L-1 NaOH 溶液450mL。
配制实验操作步骤有:a.在天平上称量g NaOH固体放入烧杯中,加水溶解,冷却至室温。b.把制得的溶液小心地注入中。c.继续向容器中加水至距刻度线1cm~2cm处,改用加水至刻度线。d.用少量水洗涤烧杯和玻璃棒2~3次。e.将瓶塞塞紧,充分摇匀。填写下列空白:
①操作步骤和正确顺序为。
②该配制过程中两次用到玻璃棒,其作用分别是、。
③在进行b步操作时,不慎有液体溅出,下列处理措施正确的是()
| A.继续进行实验 | B.添加部分NaOH溶液 |
| C.倒掉溶液,重新配制 | D.倒掉溶液,洗净容量瓶后重新配制 |
已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
(1)步骤1的主要操作需用到的玻璃仪器除烧杯外有。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式),
固体残渣的成分是(填化学式)。
(3)步骤3中涉及的操作是:蒸发浓缩、、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是。