合成氨的反应为:3H2 + N2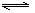 2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是
2NH3,其反应的速率可分别表示为v(H2)、v(N2)、v(NH3)(单位为mol·L-1·s-1),则下列关系正确的是
| A.v(H2)=v(N2) = v(NH3) | B.v(H2)=3 v(N2) | C.v(N2)=2 v(NH3) | D.2v(NH3)=3v(H2) |
天然维生素P(结构简式如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是: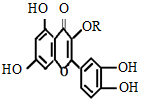
| A.可以和溴水反应 |
| B.可用有机溶剂萃取 |
| C.分子中有三个苯环 |
| D.1 mol维生素P可以和4 mol NaOH反应 |
《化学教育》报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件。这足以说明,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”。“瘦肉精”的结构可表示为:
下列关于“瘦肉精”的说法中正确的是
| A.摩尔质量为313.5 | B.属于芳香烃 |
| C.分子式为C12H19Cl3N20 | D.不能发生加成反应 |
下列有机物中,既能发生加成反应和酯化反应,又能发生氧化反应的是
| A.CH3CH2COOH | B.CH3CH2CH2OH |
| C.CH3CH2COOCH3 | D.HOCH2CH===CH2 |
下列有机反应中属于消去反应的是
由2氯丙烷制取少量的1,2丙二醇时,需要经过下列哪几步反应:
| A.加成―→消去―→取代 | B.消去―→加成―→水解 |
| C.取代―→消去―→加成 | D.消去―→加成―→消去 |