实验室用下列仪器和药品制取干燥纯净的氯气。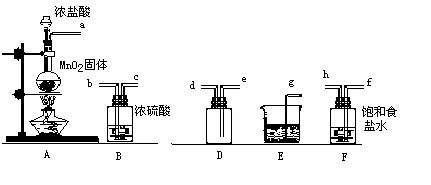
按气流从左到右,装置正确的连接顺序为( )接( )接( )接( )接( )接( )接( )接( )(填各接口字母)
装置F的作用是 ,装置E的作用是 。
装置A和E中的反应化学方程式为
 :
:某校化学兴趣小组称取8.7g二氧化锰与足量10mol/L的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1 = L
若该小组量取了10mol/L的浓盐酸40ml,与足量的二氧化锰反应,理论上产生氯气的体积为V2(标准状况),则V1 V2(填“>”、“<”或“=”),原因是
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式__________________。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是____________;若蒸发皿质量是w1 g,蒸发皿与加热后固体总质量是w2 g,则样品中铁元素的质量分数是_____。
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不在用盐酸,为什么?
__________________________。
(2)选择的还原剂是否能用铁__________(填“是”或“否”),原因是:__________。
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是____________。
( 12分)绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓。其流程可表示为: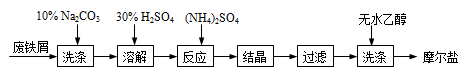
(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热。
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。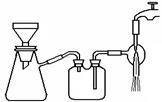
(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含
有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,
一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①本实验的指示剂是 。
| A.酚酞 | B.甲基橙 | C.石蕊 | D.不需要 |
②产品中Fe2+的质量分数为 。
( 19分)CuSO4∙5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4∙5H2O的实验室制备流程圈。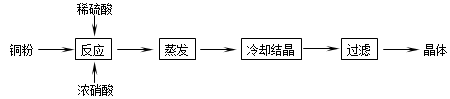
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:
、 。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4∙5H2O中可能存在的杂质是 ,除去这种杂质的实验操作称为 。
(3)称取0.1000 g提纯后的CuSO4∙5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4∙5H2O g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。在滴定中,准确读数应该是视线 。
(5)如果采用重量法测定CuSO4∙5H2O的含量,完成下列步骤:
① ②加水溶解 ②加氯化钡溶液,沉淀 ④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是 。
SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl]。
(1)写出物质A的名称:________。
(2)SnCl2用盐酸而不用水溶解的原因是____________________(用化学方程式表示)。
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:_______________。
(4)反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:____。该反应的温度需要控制在75 ℃左右的原因是____。
(5)实验室中“漂洗”沉淀的实验操作方法是____。
Na2O2与水的反应实际是Na2O2 +2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑。为了测定某过氧化钠固体的纯度,今做如下实验:
①称取过氧化钠固体2.00g
②把这些过氧化钠固体放入气密性良好的气体发生装置中
③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平
④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切
⑤取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4 溶液去滴定,至终点时用去了24.20mLKMnO4 溶液(此时锰全部以Mn2+存在)
(1)有500mL、250mL、150mL的量筒备用,应选用量程为______的量筒
(2)该实验应选用______(填“酸式”或“碱式”)滴定管
(3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,若此时量筒内的液面高于水槽中液面(如图),立即读数会使Na2O2的纯度______(填“偏高”“偏低”或“不变”);应进行的操作是 。
(4)在步骤⑤中反应的离子方程式是______判定滴定达到终点的依据是 。
(5)该过氧化钠的纯度为______(用百分数表示,保留一位小数;实验中得到的气体体积均看作为标准状况下)。