(12分)下表为元素周期表的一部分,按要求完成各小题。
 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
|
|
|
⑥ |
|
⑦ |
⑾ |
|
| 3 |
① |
③ |
⑤ |
|
|
|
⑧ |
⑩ |
| 4 |
② |
④ |
|
|
|
|
⑨ |
|
化学性质最不活泼的元素 (填元编号,下同),非金属性最强的元素是 金属性最强的单质与水反应的离子方程式为
①③⑤三种元素的最高价氧化物水化物中,碱性最强的
①③⑤三种元素的原子半径由大到小的顺序为
某元素的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水,该元素为 在两种盐中该元素的化合价为 ,该元素的最高价氧化物和盐酸反应的化学方程式为 向该元素和⑧号元素组成的化合物溶液中,缓缓滴加NaOH至过量,现象为
(13分)根据下列有机物的结构完成问题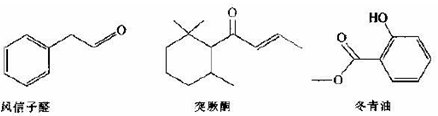
(1)可鉴别风信子醛和冬青油的试剂是 。
(2)下列关于冬青油和突厥酮的说法中正确的是 (填序号)。
| A.都属于芳香族化合物 | B.都能使酸性高锰酸钾溶液褪色 |
| C.突厥酮的分子式为C13H20O | D.都能发生水解反应 |
(3)突厥酮与溴水反应的化学方程式为 。
(4)写出符合下列条件的风信子醛的同分异构体的结构简式______(任写一种);
a.含有苯环,苯环上有两个支链
b.与新制氢氧化铜浑浊液共热无砖红色沉淀芳香烃
由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是 (填标号)。
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有 个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。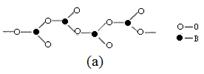
2012年8月24日,武汉市一家有色金属制造厂发生氨气泄露事故。已知在一定温度下,合成氨工业原料气H2制备涉及下面的两个反应:
C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判断反应CO(g)+H2O(g) CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(2)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)  2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。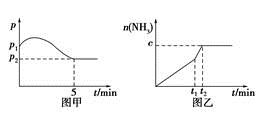
①若图中c=1.6 mol,则改变的条件是________(填字母);
②若图中c<1.6 mol,则改变的条件是__________(填字母);此时该反应的平衡常数____________。(填字母)(填“增大”、“减小”、“不变”)
A.升温
B.降温
C.加压
D.减压
E.加催化剂
(3)如(2)题中图甲,平衡时氢气的转化率为________。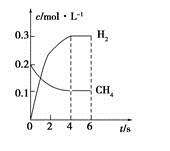
(4)工业上可利用如下反应:H2O (g)+CH4 (g)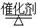 CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
X、Y、Z、E、F,5种短周期元素,它们的原子序数依次增大,X的原子半径最小,Y和Z在同周期,Z的L层电子书是K层电子数的三倍,E是短周期元素中金属性最强的元素,F和Z同主族,它们的最外层电子数和为18。请回答下列问题:
(1)X、Y、Z、E、F的原子半径从大到小的顺序为______________________(请填写元素符号)。
(2)Z、F的非金属性强弱比较_______________________(填写元素符号)Y和F的最高价氧化物的水化物的酸性大小比较____________________(填写化学式)。
(3)XYZE四种元素形成的化合物是______________(化学式),俗名为_________,请写出该化合物与E的最高价氧化物的水化物反应的离子反应方程式____________________________________。
(4)元素Y与元素Z以原子数比为1:2化合形成的化合物M,元素X和元素Z元素以原子数比为2:1化合形成的化合物Q, E与元素Z以原子个数比为1:1化合形成的化合物N,以M、Q都可以和N反应可以作为潜水艇和航空飞船的供氧剂,写出该反应的化学方程式________________、_________________。
[化学——有机化学基础]香豆素是一种重要香料,以下是两种常见香豆素。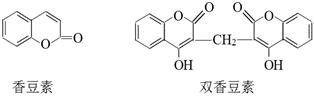
(1)关于香豆素和双香豆素,下列说法正确的是 (填序号)。
| A.分子中碳碳双键 |
| B.都属于芳香烃 |
| C.香豆素和双香豆素都能发生取代、加成、酯化反应 |
| D.1 mol双香豆素含羟基数为2NA(NA为阿伏加德罗常数的值) |
(2)以甲苯为原料生产香豆素流程如下: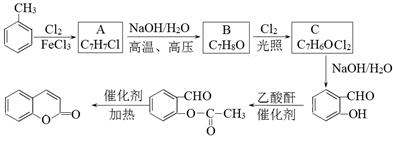
已知:(ⅰ)B可与FeCl3溶液发生显色反应;
(ⅱ)同一个碳原子上连两个羟基通常不稳定,易脱水形成羰基。
①C的结构简式是 。
②A的命名为__________________。B→C的反应类型是 。
③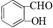 与乙酸酐(
与乙酸酐(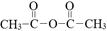 )反应,除生成
)反应,除生成 外,另一种产物是_____ 。(写出结构简式),这种产物与Na2CO3反应的方程式为________________________。
外,另一种产物是_____ 。(写出结构简式),这种产物与Na2CO3反应的方程式为________________________。
④异香豆素与香豆素互为同分异构体,具有以下特点:
(a)含有苯环;
(b)含有与香豆素相似的两个六元环;
(c)1 mol异香豆素与足量NaOH溶液反应时消耗1 mol NaOH。
写出异香豆素的结构简式_______ 。
写出异香豆素与NaOH溶液反应的方程式为__________________________________________。