工业上一般在恒容密闭容器中可以采用下列反应合成甲醇: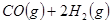


(1)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
A.生成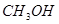 的速率与消耗 的速率与消耗 的速率相等 的速率相等 |
| B.混合气体的密度不变 |
| C.混合气体的相对平均分子质量不变 |
D.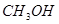 、 、 、 、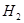 的浓度都不再发生变化 的浓度都不再发生变化 |
E. 气体的压强不再改变
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断该反应的△H__________0(填“>”、“=”或“<”);
②某温度下,将 和
和 充入
充入 的密闭容器中,充分反应后,达到平衡时测得
的密闭容器中,充分反应后,达到平衡时测得 ,则CO的转化率为__________,此时的温度为__________。
,则CO的转化率为__________,此时的温度为__________。
(3)要提高CO的转化率,可以采取的措施是__________。
a. 升温 b. 加入催化剂 c. 增加CO的浓度
d. 恒容下加入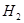 使压强变大 e. 恒容下加入惰性气体使压强变大 f. 分离出甲醇
使压强变大 e. 恒容下加入惰性气体使压强变大 f. 分离出甲醇
(4)在250℃时,某时刻测得该温度下的密闭容器中各物质的物质的量浓度见下表:
| CO |
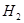 |
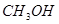 |
| 0.5 mol·L—1 |
2mol·L—1 |
6mol·L—1 |
此时反应的正、逆反应速率的关系是:v(正) v(逆)(填“大于”“小于”或“等于”)。
(5)如图1所示,甲为恒容密闭容器,乙为恒压密闭容器。在甲、乙两容器中分别充入等物质的量的H2和CO,使甲、乙两容器初始容积相等。在相同温度下发生上述反应,并维持反应过程中温度不变。已知甲容器中CO的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO的转化率随时间变化的图像。
现有分子式为C10H10O2Br2的芳香族化合物X,X中苯环上有四个取代基,其中一个是酯基,苯环上的一氯代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,D和E遇FeCl3溶液显色且能与浓溴水反应。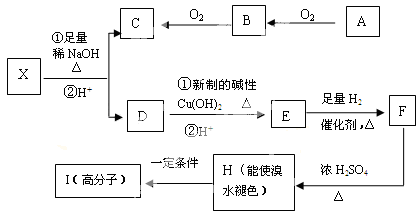
已知:
① 在稀碱溶液中,连在苯环上的溴原子不易发生水解
②两个羟基同时连在同一碳原子上的结构是不稳定的,它将自动发生脱水反应,如CH3CH(OH) 2 → CH3CHO + H2O
回答下列问题:
(1)H的分子式是
(2)C的结构简式为 I的结构简式为
(3)H→I反应类型是
(4)E不易发生的化学反应类型有(选填序号)
A、取代反应B、消去反应C、氧化反应 D、银镜反应
(5)下列有关D物质的叙述中正确的是(选填序号)
A、D物质能与碳酸钠反应
B、D物质苯环上有四个取代基
C、D物质有氧化性,没有还原性
D、D物质是芳香烃
(6)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:
②F→H的化学方程式:
工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 |
乙烯氧化法 |
|
| 原料 |
乙炔、水 |
乙烯、空气 |
| 反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
| 平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
| 日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 |
|
| 乙炔 |
 |
| 乙烯 |
来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛__________________________________________________。
b.乙烯氧化法制乙醛______________________________________________。
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法,分析可能的原因(从环境、原料来源、能耗等角度分析,任写一点):________________________________________________。
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?_________________________。
(4)若将上述两种方法的反应条件,均增加“100个标准大气压”,原料转化率会再增大一些,但在实际生产中却不采用这样的方法,理由是_____________________________。
(5)如果某工厂以乙烯为原料,通过3步可以制得聚氯乙烯,请写出合理的反应方程式(无机试剂和溶剂等任选,该过程中不发生取代反应)
_______________________________________________________
_______________________________________________________
_______________________________________________________
咖啡酸具有止血、镇咳、祛痰等疗效,其结构为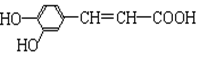
(1)咖啡酸分子中的含氧官能团的名称为、;
(2)有关咖啡酸性质的叙述错误的是;
A.在浓硫酸、加热条件下能发生消去反应
B.既能和浓溴水发生加成反应也能发生取代反应
C.能与酸性高锰酸钾溶液反应
D.1mol 咖啡酸在一定条件下能与4molH2发生加成反应
(3)有机物A(分子式为C11H12O4)在一定条件下能发生如下转化:
①D、E的结构简式分别为、;
②B→C反应的化学方程式为;
(4)R是咖啡酸的同分异构体,具有如下特点:①R具有 结构;②能发生水解反应;R的结构简式为(任写1种)。
结构;②能发生水解反应;R的结构简式为(任写1种)。
取3.40g只含羟基,不含其他官能团的液态饱和多元醇,置于5.00L氧气中,经点燃,醇完全燃烧,反应后气体体积减少0.56L,将气体经CaO吸收,体积又减少2.80L(所有气体体积均在标准状况下测定)。
(1)3.40g醇中C、H、O物质的量分别为:C________mol,H________mol,O________mol,该醇中C、H、O的原子个数比为__________。
(2)由以上比值能否确定该醇的分子式__________(填“能”或“否”)。其原因是____________。
(3)如果将多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有1种,写出该饱和多元醇的结构简式_____________________。
化学与社会经济建设、生态文明建设、人类健康保障等密切相关。
(1)材料是经济和生态文明建设的重要物质基础。
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是。
②橡胶是制造轮胎的重要原料,橡胶属于(填字母)。
A.金属材料 B.无机非金属材料C.有机高分子材料
③钢铁制品在潮湿的空气中能发生腐蚀。发生该腐蚀时的负极反应式为。
(2)防治环境污染,改善生态环境已成为全球共识。
①2013年全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是____(填字母)
A.O2B.CO2C.PM2.5
②采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾.
A.废电池 B.易拉罐 C.玻璃瓶
在焚烧处理前,除废电池外,还有(填字母)应剔除并回收,随意丢弃电池造成的主要危害是。
③漂白粉可用于生活用水的杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是。
(3)人体健康与食品、药物等关系密切。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取______________(选填“脂肪”、“维生素”或“蛋白质”)不足引起的。
②生活中应合理地摄取人体必需的元素,体内________含量过高,会引起甲状腺疾病。
③可以帮助流感病人解热镇痛的药物是____________(选填“青霉素”或“阿司匹林”)。
④胃舒平(氢氧化铝)可用于治疗胃酸过多,请写出有关离子方程式_________________。