某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究。实验所得数据如下表。就本实验的有关问题,请填空:
| 实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) (已折算为标况) |
耗时(s) |
||
| 化学式 |
质量(g) |
实际回收 |
||||
| 1 |
0.6 |
— |
— |
— |
10 |
480 |
| 2 |
0.6 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
| 3 |
0.6 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
| 4 |
0.6 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
| 5 |
0.6 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
(1)本实验的装置由下图三部分组成,其正确的接口连接顺序为 。
(2)为证明编号2的实验中MnO2起到催化作用,上述实验后还要测定反应剩余物MnO2的质量,实验的操作顺序是:溶解→ → → → 。
(3)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为 (填物质的化学式)。
(4)从编号3的实验数据,可计算出KClO3的分解率为 %(保留一位小数)。
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是______(填化学式),常用 试纸检验该气体,上述异常现象产生的原因是 。
Ⅰ.拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。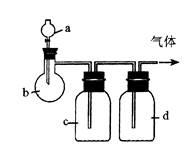
| 气体 |
a |
b |
c |
d |
| C2H4 |
乙醇 |
浓H2SO4 |
NaOH溶液 |
浓H2SO4 |
| Cl2 |
浓盐酸 |
MnO2 |
NaOH溶液 |
浓H2SO4 |
| NH3 |
饱和NH4Cl溶液 |
消石灰 |
H2O |
固体NaOH |
| NO |
稀HNO3 |
铜屑 |
H2O |
P2O5 |
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
① 气体_____________,理由是____________________________ 。
② 气体_____________,理由是____________________________ 。
③ 气体_____________,理由是____________________________ 。
④ 气体_____________,理由是____________________________ 。
Ⅱ.用下图装置进行实验,将A逐滴加入B 中。
(1)若A为醋酸,B为石灰石,C为C6H5ONa溶液,则在 小试管中发生的现象是_______________,其中发生反应的化学方程式为_______________________。
(2)若B为生石灰,实验中观察到C溶液中先产生沉淀,而后沉淀逐渐溶解。当沉淀恰好溶解时,关闭E,然后向烧杯中加入热水,静置片刻,观察到试管壁上出现银镜。则A是_________,C是__________和乙醛的混合液,发生银镜反应的化学方程式为____________________________仪器D在实验中的作用是__________________。
海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘: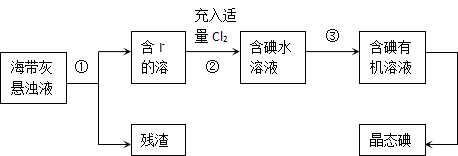
(1)指出上图中提取碘的过程中有关的实验操作名称:① 。
(2)操作③中所用的有机试剂可以是 (只填一种)。
(3)操作过程③可以分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
E. 旋开活塞,用烧杯接收溶液;
F. 从分液漏斗上口倒出上层液体;
G. 将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H. 静置、分层。
(a)过程③正确操作步骤的顺序是:(填编号字母) ;
(b)上述G步操作的目的是: ;
(c)最后碘的有机溶液是通过 获得(填“漏斗上口”或“漏斗下口”)。
(4)从含碘的有机溶液中提取碘和回收有机试剂,还需要经过蒸馏,观察图所示实验装置指出其错误之处 。
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
(1)在图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.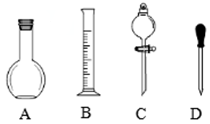
(2)在容量瓶的使用方法中,下列操作不正确的是______
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
(1)图中的两处明显的错误是
_____________________________________,
_____________________________________。
(2)A仪器的名称是____________________,
B仪器的名称是_____________________。
(3)实验时A中除加入少量自来水外,还需加入少量_____________,其作用是________________________。
实验需要0.1mol/LNaOH溶液450ml,根据溶液配制中情况回答下列问题:
(1)实验中必须用到的玻璃仪器有: 。
(2)根据计算得知,所需NaOH的质量为 g。
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A.用50mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的NaOH的质量,倒入烧杯中加入适量水,用玻璃棒慢慢搅动。
C.将已冷却的NaOH溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.加水至离刻度线1~2cm处改用胶头滴管加水,使溶液凹面恰好与刻度相切
(4)下列操作对所配浓度有何影响(填写字母)
偏大的有 ;
偏小的有 ;
无影响的有 。
A.称量用了生锈的砝码;
B.将NaOH放在纸张上称量;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中;
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。