(1)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
请在如图中标明电极材料和电解质溶液的名称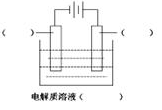
已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为 ________(填化学式)。
(2)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
2PbSO4+2H2O  Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42-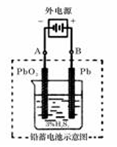
在完全放电耗尽PbO2和Pb时,若按上图所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g。请回答下列问题: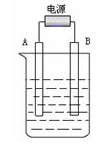
①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为 ________。(假设电解前后溶液的体积不变)
在a、b两支试管中,分别装入足量Na2CO3粉末,然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白。
(1)a、b两支试管中的现象:相同点是__________,不同点是__________________。原因是__________________。
(2)a、b两支试管中生成气体的速率开始时是a__________b,反应完毕后生成气体的总体积是a__________b,原因是__________________。
(1)在其他条件不变的情况下,研究改变起始氢气物质的量[用n(H2)表示]
对N2(g)+3H2(g) 2NH3(g)反应的影响且△H<0,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响且△H<0,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量): 
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时N2、H2的转化率均为60%,则在起始时体系中加入N2的物质的量为__________mol,NH3体积分数为_________,此条件下(T2),反应的平衡常数K=_________,当温度升高时该平衡常数将__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH3+5O2 4NO+6H2O ,4NH3+3O2
4NO+6H2O ,4NH3+3O2 2N2+6H2O温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是
2N2+6H2O温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2. 40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,平衡时,CO的浓度为________。
(2)反应①为________(选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡,要使该平衡向右移动且能增大CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900 ℃
D.使用合适的催化剂 E.增加Fe的量
(4)下列能说明反应②达到平衡状态的是________。
a.每消耗1 molCO的同时生成1 mol CO2 b.体系压强保持不变
c.v正(O2)=v逆(CO2) d.容器中混合气体的密度保持不变
e.混合气体中CO的体积分数保持不变 f.CO和O2的体积比保持不变
在一个密闭容器中,发生下列反应:C(s)+H2O(g)  CO(g)+H2(g) ΔH>0,达到平衡后,试回答下列问题
CO(g)+H2(g) ΔH>0,达到平衡后,试回答下列问题
(1)上述正向反应是:反应(填:放热、吸热)。
(2)该反应的化学平衡常数表达式为K=。
(3)恒温恒容通人H2O(g),原化学平衡向反应方向移动(填“正移”、“逆移”“不移”下同)c(CO)____(填“增大”、“减小”或“不变” 下同)。
(4)减小密闭容器的容积,保持温度不变,原化学平衡向反应方向移动,v(正) 。
(5)某温度下上述反应平衡时,恒容、降低温度,原化学平衡向反应方向移动,容器内混合气体的压强。
下图是八种有机化合物的转换关系。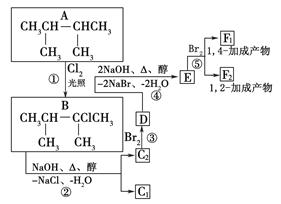
请回答下列问题:
(1)根据系统命名法,化合物A的名称是________。
(2)上述框图中,①是________反应,③是________反应(填反应类型)。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:________。
(4)C2的结构简式是__________________。F1的结构简式是________________。F1和F2互为
_______________。
(5)上述八种化合物中,属于二烯烃的是________。二烯烃的通式是________。