(化学-有机化学基础)A、B、C、D四种芳香族化合物的结构简式如下所示:
请回答下列问题:
(1)D中含氧官能团的名称为 。
(2)用A、B、C、D填空:能发生银镜反应的有 ;既能与FeCl3溶液发生显色反应又能与Na2CO3溶液反应放出气体的是 。
(3)按下图C经一步反应可生成E,E是B的同分异构体,
则反应①的反应类型为 ;写出反应②的化学方程式: 。
(4)G、H和D互为同分异构体,它们具有如下特点:
① G和H是苯的二元取代物,这两个取代基分别为羟基和含有-COO-结构的基团;
② G和H苯环上的一氯代物有两种不同结构;
③ G可以发生银镜反应,H分子中苯环不与取代基碳原子直接相连。
写出G和H的结构简式:G: ;H: 。
80℃时,将0.40mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 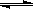 2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H>0隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| N(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为mol·L-1·s-1
(2)计算在80℃时该反应的平衡常数K=;
(3)要增大该反应的K值,可采取的措施有(填序号);
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO2 |
C.使用高效催化剂 | D.升高温度 |
(4)如右图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。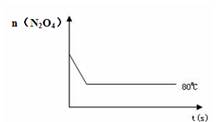
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁
年产量的1/4。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极:;负极:。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用。(请写出具体金属名称)
(3)下图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源
的极。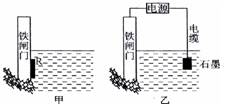
将镁、铝的混合物0.1mol 溶于100mL 2mol/LH2SO4溶液中,然后在得到的溶液中滴加1mol/LNaOH 溶液,请回答:
(1)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好完全沉淀,则加入NaOH溶液的体积是V(NaOH)=________mL。
(2)若在滴加NaOH溶液过程中,沉淀的质量随加入NaOH溶液的体积变化如下图所示。当V1=160mL时,求金属粉末中镁的物质的量和V2的体积?(要求写出解题过程)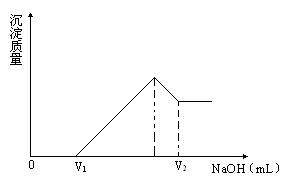
(3)若混合物仍为0.1mol ,其中Mg的物质的量分数为a,用100mL 2mol/L的H2SO4溶解此混合物后,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3,则满足此条件的a的取值范围为。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
① 写出制取高铁酸钠的化学方程式:;
② 在制取高铁酸钠的反应中元素被氧化;
③ 高铁酸钠杀菌作用是利用了其具有的,而净水作用的原因是。
(2)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的溶液中逐滴加入氢氧化钠溶液,将发生一系列变化。已知,NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++A1O2-+H2O=Al(OH)3↓+ NH3↑ ,试回答:
① 硫酸铝铵在水溶液中的电离方程式为;
②在向该复盐的溶液中逐滴加入氢氧化钠溶液,请在下图中画出加入氢氧化钠溶液的体积与沉淀物质的量之间的关系。
现有A、B、C、D、E五种离子化合物形成的溶液,分别由K+、NH4+、Ag+、Ba2+、Fe3+、Cl-、OH-、CO32-、SO42-、NO3-中的阳离子和阴离子各一种组成(五种离子化合物所含阴、阳离子各不相同)。已知:①室温时,0.1 mol·L-1B溶液的pH=10,②C、D、E三种溶液的pH均小于7,③C溶液分别与其他四种溶液反应均生成沉淀,④A溶液与D溶液在加热条件下反应既产生白色沉淀又产生刺激性气味的气体,生成的白色沉淀不溶于稀硝酸。
(1)试根据以上实验事实可以推断(用化学式表示)
B为_________;C为_________;D为________。
(2)写出下列反应的离子方程式:
A溶液与D溶液混合(加热);
C溶液与E溶液混合。