.现实验室中有一包由碳酸钠和氧化钙组成的白色粉末,下面是某化学兴趣小组的同学进行的探究过程,请你按要求帮助完成探究活动。
(1)同学们将白色固体放在如右图装置的试管中,打开分液漏斗开关,向试管中滴加水,观察到伸入烧杯中的导管口有气泡冒出,产生这种现象的原因是 ,产生这种现象涉及的化学方程式是 。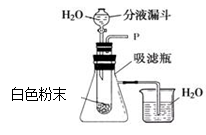
(2)同学们将如上图装置的试管中继续加入足量的水,发现试管中形成浑浊液体,于是同学们对浑浊液进行探究,其实验过程如下: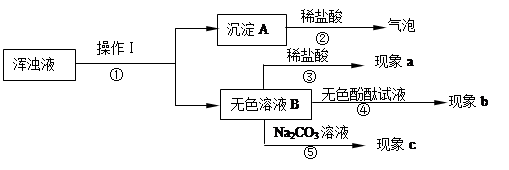
A.操作Ⅰ是 ,在该操作中用到的玻璃仪器有漏斗、烧杯和 。
B.沉淀A的化学式是 。同学们认为无色溶液B一定含有的溶质是 ,对无色溶液B含有的其它溶质他们提出二个猜想:
猜想1:无色溶液B中的溶质还有Na2CO3;
猜想2:无色溶液B中的溶质还有 。
根据上面实验流程回答:现象b是 。若猜想1成立,则现象a是 ,此时③反应的化学方程式是 ,若猜想2成立的现象是 。
我国道教发源地山东威海圣经山摩崖石刻,为国内罕见的大型道教石刻,可称为瑰宝。圣经山摩崖石刻的材质是大理石,主要成分是碳酸钙,现在字迹已模糊不清。摩崖石刻被腐蚀,是否是酸雨所致?试回答下列问题:
(1)酸雨的成因:即使大气没有受到污染,正常的雨水或河水也呈微弱酸性(
在5.6~7之间),原因是。酸雨的酸性比正常雨水强,是因为雨水吸收了被污染的大气中的等有害气体。大气中这些有害气体主要来自于。
(2)定量实验探究:
查阅资料及定性实验表明:
(1)醋酸和酸雨的酸性程度差不多, 在5.6~3之间;
(2)酸雨(醋酸)确实能加重大理石腐蚀的程度;
(3)定性实验显示:将大理石放入
=3的醋酸溶液中,短时间内几乎看不出有气泡产生。
现提供下列仪器和试剂:
仪器:烧杯、托盘天平、镊子、量筒、胶头滴管。
药品:
=6.5的普通雨水、
=3醋酸溶液、大理石薄片。
请你设计一个"定量实验方案",证明摩崖石刻被腐蚀,主要与酸雨有关,与普通雨水无关。
| 实验内容及步骤 |
应得到的实验结果 |
(3)下列与保护摩崖石刻有关的说法中,你同意的是( )
A.了解哪种人类活动最容易引起酸雨
B.引起酸雨原因的结论应建立在科学研究的基础上
C.保护摩崖石刻要建立在有关损坏原因的科学证据的基础上
D.要从根本上预防酸雨的危害,应禁止工厂和汽车排放气体
E.要减少酸雨的危害,应研究和推广减少有害气体排放的技术
F.要从根本上保护摩崖石刻,主要应研究修复被酸雨损伤的摩崖石刻的方法与技术
(9分) 在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
⑴写出试管②中碳酸钠与氢氧化钙反应的化学方程式:
。
⑵实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】 小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是(写一种猜想)。
【讨论】你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由。
【实验设计】设计一个简单的实验证明你的猜想正确。
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中, |
你的猜想正确 |
【实验分析】小亮同学针对自己的猜想进行了如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中,滴入几滴稀盐酸 |
没有气泡产生 |
自己的猜想不成立 |
你认为小亮同学对实验结果判断是否正确?请说明理由。
【反思拓展】
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑
;
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水
道?。
某同学家新换了淋浴喷头,从说明书上了解到该喷头是铜质镀铬的。他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动。
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀的致密氧化膜。铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液……
铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液……
【实验过程】取大小相同的三种金属薄片,用砂纸打磨光亮。
| 实验一 |
实验二 |
实验三 |
|
实验 方案 |
 |
 |
 |
| 实验 现象 |
铬片表面产生气泡缓慢,溶液变蓝色 |
无明显现象 |
铝片表面产生气泡较快 |
| 结论 |
铬能和稀硫酸发生反应,反应速率较慢 |
铜不与稀硫酸反应 |
铝能与稀硫酸发生反应,反应速率较快 |
| 三种金属在金属活动性顺序中的相对位置关系是__________________________ |
【回答问题】(1)用砂纸打磨金属片的目的是_____________________。
(2)实验一发生反应的化学方程式是____________________________。
(3)甲同学提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,你认为____________(填“可行”或“不可行”)。
(4)已同学认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品应该是________________。
【归纳】比较金属活动性强弱的方法有:
①____________;
②通过金属与盐溶液反应判断金属活动性强弱 。
请你参与某学习小组研究性学习的过程,并协助完成相关任务。
【研究课题】探究水壶内部水垢的主要成分
【查阅资料】通过查阅资料知道,天然水和水垢所含的物质及其溶解性如下表:
| 物质 |
Ca(HCO3)2 |
Mg(HCO3)2 |
Ca(OH)2 |
Mg(OH)2 |
CaCO3 |
MgCO3 |
| 溶解性 |
可溶 |
可溶 |
微溶 |
不溶 |
不溶 |
微溶 |
【提出猜想】水垢的主要成分一定含有Mg(OH)2和 ,可能含有Ca(OH)2和。
【设计方案】
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,静置。取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无(填化学式)。
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分。
其主要实验步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,逐滴加入足量稀盐酸。若D瓶增重22g,则水垢全部是CaCO3。
②待锥形瓶中不再产生气泡时,打开活塞b,从导管a处缓缓鼓入一定量的空气;
③称量D瓶内物质增加的质量;
④重复②和③的操作,直至D瓶内物质质量不变。测量滴加稀盐酸体积与D瓶内物质增加质量的关系如图曲线所示;
【评价】
(1)A瓶中的NaOH溶液起到作用。若A瓶中无NaOH溶液,D瓶中的质量将(填“增大”、“不变”或“减小”)。
(2)一般情况下,两种不同金属形成的碳酸盐与足量盐酸反应时,若两金属的化合价相同、两种盐的质量相同,则相对分子质量小者放出的气体多。分析曲线图可知:水垢中一定含有 (化学式),理由是。
(3)装置图中“?”所指处有三根导管同时穿过橡胶塞,已知:导管的直径为8mm,橡胶塞细段直径为3cm。从坚固和美观的角度考虑,请你在由图中标出应在哪三点打孔为好(用圆圈“○”表示打孔位置)。 
以上实验(填“能够”或“不能”)检测出水垢中含有Mg(OH)2。
(6分)小林、小军和小明在实验室用如图装置做CaCO3受热分解的实验,加热一段时问后,他们对试管内固体的成分进行探究。
【提出问题】加热CaCO3后试管内的固体成分是什么?
【建立假设】小林的假设:CaCO3未分解,固体成分为CaCO3;
小军的假设:CaCO3完全分解,固体成分为;
小明的假设:CaCO3部分分解,固体成分为。
【收集证据】(1)小军取少量固体于试管中,加适量水振荡后静置,再滴
几滴无色酚酞试液,溶液变红。可知小军加水时发生反应的
化学方程 式为————————。
(2)小明向小军实验后的试管中滴加过量稀盐酸,发现有气泡生成。
【获得结论】通过实验可知的假设是成立的。
【交流与评价】实验结束后,在组内交流讨论过程中部分同学提出:在实验中若增加下列仪器中的(填编号)就可以直接根据实验现象判断CaCO3是否分解。