碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l) = Zn(OH)2(s)+Mn2O3(s)下列说法错误的是
| A.电池工作时,锌做负根 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电流由正极通过外电路流向负极 |
| D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g |
下列对Na2CO3的叙述不正确的是( )。
| A.该物质属于盐类 |
| B.该物质既含金属元素又含非金属元素 |
| C.该物质不能发生化合反应 |
| D.该物质有时候能和NaOH划为一类 |
对于常温下pH=3的乙酸溶液,下列说法正确的是
| A.与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多 |
| B.加水稀释到原体积的10倍后溶液pH变为4 |
| C.加入少量乙酸钠固体,溶液pH升高 |
| D.溶液中粒子浓度大小关系为: c(H+)>c(CH3COOH) > c(CH3COO-)>c(OH-) |
短周期元素A、B、C、D的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,D位于第VIA族。下列说法正确的是:
A.原子半径:D>B>C>A
B.元素A、B的氧化物具有相同类型的化学键
C.元素B和C的最高价氧化物对应水化物的碱性:B>C
D.B、C、D的最高价氧化物对应的水化物能相互反应
下列实验方案不能达到实验目的的是:
| 实验目的 |
实验方案 |
|
| A |
证明溴乙烷发生消去反应有乙烯生成 |
向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B |
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 |
| C |
检验蔗糖水解产物具有还原性 |
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D |
探究温度对化学平衡的影响 |
将NO2球浸泡在冷、热水中,观察颜色的变化 |
下列有关铜锌原电池(如图)的叙述正确的是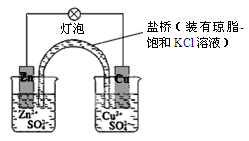
| A.正极反应为Zn-2e-=Zn2+ |
| B.电池反应为Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.取下盐桥,原电池仍可工作 |