向盛有少量苯酚晶体的试管加入2ml蒸馏水,振荡试管,观察到的现象为 ,向试管中逐滴加入5%的NaOH溶液并振荡试管,现象 ,反应的化学方程式为
再加入稀盐酸,现象为
化学反应方程式为 。
向盛有少量苯酚稀溶液的试管逐滴加入饱和溴水,观察到的现象为
化学方程式为:
这个实验很灵敏,可用于苯酚的定性检验和定量测定。
使用某些高分子材料给环境造成“白色污染”,后果严重。最近研究的一些可分解性塑料有良好的生物适应性和分解性,能自然腐烂分解。如:
已知3HB的单体叫3羟基丁酸,则
(1)4HB的单体名称是____________;3HV的单体名称是____________。
(2)两分子3HV的单体脱水时,生成的环酯的结构简式是____________________。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图所示。
加热聚丙烯废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数/% |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物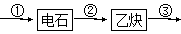 聚乙炔
聚乙炔
写出反应②③的化学方程式:__________________________。
(2)B中收集得到的物质中能使酸性KMnO4溶液褪色的物质的一氯代物有________种。
(3)锥形瓶C中观察到的现象是______________。经溴水充分吸收,剩余气体经干燥后平均相对分子质量为________。
(4)写出C中逸出的气体在工业上的两种用途__________、____________。
有机高分子化合物在日常生活中有非常广泛的应用。一种广泛应用于电器、工业交通的工程塑料DAP的结构简式是:
试回答:
(1)生产DAP工程塑料的单体的结构简式是__________________________。
(2)DAP工程塑料的单体,可以由两种有机物通过一步反应合成出来,则这两种有机物的结构简式是____________________和_______________。
最近医用化学杂志报道,用聚乙交酯纤维材料所制成的医用缝合线比天然高分子材料(如肠线)还好。聚乙交酯纤维的化学结构简式可表示为 ,它是用中间有机物
,它是用中间有机物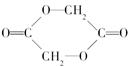 聚合而成的。
聚合而成的。
(1)试推导聚乙交酯纤维的单体______________________________________。
(2)写出有关反应的化学方程式______________________________________。
写出下列高分子化合物的化学方程式:
(1)CH2=CH—CN发生加聚反应:___________________________;
(2)CH2=CH2发生加聚反应:________________________________;
(3) 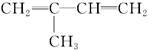 发生加聚反应:______________________________;
发生加聚反应:______________________________;
(4)乙二酸与乙二醇发生缩聚反应:________________________________;
(5) 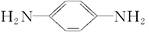 与乙二酸发生缩聚反应:_______________________________。
与乙二酸发生缩聚反应:_______________________________。