A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增,B、C、D在同一周期。已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成含配位键的离子化合物。请回答:
(1)A、D形成的三原子分子中心原子杂化类型是 ,分子空间构型为 。
(2)B、C、D氢化物稳定性由强到弱的顺序为 (用化学用语回答,下同),B、C、F最高价含氧酸酸性由强到的顺序为 ,B、C、D、E第一电离能由小到大的顺序为 ;
(3)元素A、D、E形成的化合物分子式为 ,其中含有的化学键类型有 。
(4)C的氢化物极易溶于D的常见氢化物,列出所有可能的原因
(1)有机化合物A、B分子式不同,它们只可能含C、H、O元素中的两种或三种。如果将A、B不论以何种比例混合,只要其物质的量之和不变,完全燃烧时消耗O2和生成H2O的物质的量也不变。那么A、B组成必须满足的条件是______________。若A为CH4,则符合上述条件的B中相对分子质量最小的是______________ (写分子式),并写出相对分子质量最小且含甲基的B的两种同分异构体的结构简式______________、______________。
(2)一定量的乙醇在氧气不足时燃烧,得CO2、CO和H2O共27.6 g,若其中水为10.8 g,则CO的质量为______________。
A.1.4 g B.2.2 g C.4.4 g D.2.2 g和4.4 g之间
分子式为C2H6O的化合物A具有如下性质:
A+Na 慢慢产生气泡
慢慢产生气泡
A+CH3COOH 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是______________。
| A.一定含有—OH | B.一定含有—COOH |
| C.A为乙醇 | D.A为乙醛 |
(2)含A的体积分数为75%的水溶液可以用作_______________。
(3)A与钠反应的化学方程式为_______________________________________________。
(4)化合物A和CH3COOH反应生成的有香味的产物的结构简式为___________。
(1)已知化合物B3N3H6(硼氮烷)与C6H6(苯)的分子结构相似,如下所示,则硼氮烷的二氯取代物B3N3H4Cl2的同分异构体数目为______________。
| A.2 | B.3 | C.4 | D.6 |
(2)某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使紫色石蕊溶液变红,已知:
①化合物A和G的结构简式A:___________、G:___________。
②与G同类的同分异构体(含G)有___________种。
(3)某高聚物的结构如下:
合成该高聚物分子的结构简式为: ______________________、______________________。
某温度下0.1 mol·L-1Na2CO3溶液中,c(Na+)/c(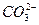 )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(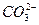 )=5/2>20/9,其原因是_________,此时c(
)=5/2>20/9,其原因是_________,此时c( )=_________。
)=_________。
现有电解质溶液:①Na2CO3②NaHCO3
③NaAlO2④CH3COONa⑤NaOH。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是__________(填编号)。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,pH变化最大的是__________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是__________(填编号)。
(4)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为__________。