照相底片的感光材料上含有一层AgBr胶体粒子的明胶,照相感光过程中,在光的作用下,AgBr分解成“银核” AgBr→Ag+Br 显影时,感光材料经过显影液作用,含有银核的AgBr粒子被还原为金属银,成为黑色成像,而大量未感光的AgBr粒子在定影时,与定影液中的硫代硫酸钠(Na2S2O3)反应形成 [Ag(S2O3)2]3-络离子而溶解于定影液中:
Ag+ + 2S2O32-= [Ag(S2O3)2]3-
本实验采用简单的化学沉淀方法从废定影液中回收银的方法。其原理是在废定影液中加入硫化钠与定影液中的络离子中的银转化为Ag2S沉淀,并使定影液再生,;再将硫化银送至高温炉灼烧,硫化银就分解为单质银和二氧化硫气体,就达到回收银的目的。
(1)写出Na2S与Na3[Ag(S2O3)2]反应的化学方程式
(2)如果废定影液中含银量为5.68g.L-1 试计算2升废定影液中至少加入Na2S的物质的量是 。(保留小数点后四位数)
已知1 mol CuSCN在下列反应中失去7 mol电子,完成并配平下列化学反应方程式:CuSCN+KMnO4+H2SO4——HCN+CuSO4+MnSO4+K2SO4+H2O
已知氧化还原反应:NaNO2+NH4Cl——NaCl+H2O+N2↑,若得到m mol的N2,则电子转移数为__________个,此时氧化产物与还原产物的质量之比为____________。
对于CO中毒、心肌梗塞、冠心病或小儿肺炎等危重患者都要采用吸氧治疗。普通医务室中没有氧气瓶,但一般都有消毒用的30%的过氧化氢溶液。同时还有可选用的试剂:KMnO4、HCl、H2SO4、MnO2、Mg粉、CuSO4、NaCl、葡萄糖。请写出一种能使过氧化氢中氧完全释放出来的反应方程式:_____________________________________________。
有两份铜屑,将它们分别与足量的浓H2SO4和稀HNO3完全反应。若放出的气体在常温常压下体积相同,则这两份铜屑的质量比是________。
配平下列氧化还原方程式,并完成以下问题。
(1)P4+HNO3+H2O——H3PO4+NO↑,该反应中氧化产物是_____________________。
(2)Fe+H2SO4(浓)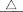 Fe2(SO4)3+SO2↑+H2O,此反应中,被氧化的元素名称是________,所得还原产物名称为________。
Fe2(SO4)3+SO2↑+H2O,此反应中,被氧化的元素名称是________,所得还原产物名称为________。