(14分)根据下图所示装置回答问题: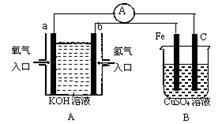
(1)装置A中a电极的电极反应式为 ,b电极的电极反应式为 ;
(2)装置B中C为 极,电极反应式为 。
(3)当铁电极的质量变化为19.2g时,a极上消耗O2在标准状况下的体积为 L。
(4)当装置A中消耗0.05mol氢气时,装置B中溶液的pH为 。(溶液体积为100mL不变)
(5)若将装置B改为电解精炼铜,则粗铜作 极,另一极反应为 。
维生素C又叫抗坏血酸,是一种水溶性维生素。在所有维生素中,维生素C是最不稳定的。在贮藏、加工和烹调时.容易被破坏,它还易被氧化和分解。
(1)维生素C的分子式是;(2)分子中除酯基外,另一含氧官能团的名称是。
(8分)下列三种有机物中:
| A.CH3COOH | B.SiO2 | C.C2H5OH | D.饱和Na2CO3溶液 |
(1)水溶液显酸性且是食醋的主要成分是(填编号,下同)。
(2)制造光导纤维的原材料是___________。
(3)湘西名酒酒鬼酒的主要成分是。
(4)用于除去乙酸乙酯中的乙酸是。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是;电解液中H2SO4的浓度将变________,当外电路通过1mol电子时,理论上负极板的质量增加g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________。
830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)△H<0 ,试回答下列问题:
CO2(g)+H2(g)△H<0 ,试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”),你判断的依据是
(3)若降低温度,该反应的K值将,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。