二氧化硅晶体是立体的网状结构,其晶体模型如图所示。认真观察晶体模型并回答下列问题:
(1) 二氧化硅是一种 晶体。
(2) 二氧化硅晶体中最小的环为 元环。
(3) 每个硅原子周围有 个氧原子。
有3种可溶性离子化合物A、B、C,它们分别由阳离子NH4+、Na+、Cu2+ 和阴离子OH-、S2-、SO42-两两结合而成,取质量相等的A、B、C分别溶解于水,配成等体积的溶液,这3种溶液物质的量浓度大小的顺序是B>A>C根据题意回答下列问题:
(1)推断出A是___________,B是___________,C是___________。
(2)室温时C溶液的pH___________7(填>、=、<=)。
(3)写出A与B溶液混合发生反应的离子方程式___________________________;
苯环上原有取代基对苯环上再导入另外取代基的位置有一定影响。其规律是
(1)苯环上新导入的取代基的位置主要决定于原有取代基的性质;
(2)可以把原有取代基分为两类: ①原取代基使新导入的取代基进入苯环的邻、对位;如:-OH、-CH3(或烃基)、-Cl、-Br等;②原取代基使新导入的取代基进入苯环的间位,如:-NO2、-SO3H、-CHO等。现有下列变化:(反应过程中每步只能引进一个新的取代基)
 |
(1)请写出其中一些主要有机物的结构简式:
ABCD
(2)写出①②两步反应方程式:,
21.。
有机物A是一种重要化工生产的中间体,已知结构简式为 :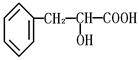
(1)A中含的官能团有:
(2)A可能具有的化学性质有:(填写序号)
① 能与H2发生加成反应 ②能与甲醇发生酯化反应 ③能与甲酸发生酯化反应
④ 在浓硫酸和加热的条件下发生消去反应 ⑤能与A g(NH3)2OH溶液发生氧化反应
(3)在一定条件下,用有机物A可以合成高分子化合物C [(C9H8O2)n ]。请写出反应的化学方程式(要求有机物写结构简式):
。
现有XYZ三种元素。
(1)X的单质可以在Z的单质中燃烧生成XZ,火焰为苍白色。
(2)XZ极易溶于水,其水溶液可使蓝色石蕊试纸变红。
(3)X、Y、Z的单质在常温下为气体。
(4)两分子X的单质可以和Y单质化合生成两分子X2Y(常温下为液体)。
(5)Z的单质溶于X2Y中得到溶液具有漂白性,推断
①XYZ各为何元素(写元素符号)?X__________ Y__________ Z__________
②XZ和X2Y各是什么物质(写化学式)? XZ__________ X2Y__________
据报道,苏州一女士骑自行车随助力车行走,因大雾堵车在许多助力车排放的尾气中呆久后突然晕倒,路人急将其送往医院抢救。化学兴趣小组同学看报后组织讨论以下两个问题,请你参考:
(1)该女士昏倒的原因: 。
(2)讨论中某同学为解决助力车污染空气的问题,提出以下几点建议:①用浓氢氧化钠溶液吸收尾气中有毒成分;②用灼热的氧化铜把尾气中有毒成分反应出去;③控制行驶的助力车的数量;④改进助力车发动机的结构,提高汽油燃烧效率。你认为切实可行的是 ,试分析不行的原因 。