A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的是
| A.A和M原子的电子总数之和可能为11 | B.A和M的原子序数之差为8 |
| C.A和M原子的最外层电子数之和为8 | D.A和M原子中未成对电子数相等 |
一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:
X(g)+Y(g)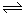 Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
| A.向平衡后的体系中加入1mol M,平衡向逆反应方向移动 |
| B.用X表示此反应的反应速率是(0.1—0.1a)mol·(L·min)—1 |
| C.向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动 |
| D.当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
根据相关化学知识分析,下列推断正确的是
| A.若X原子中的质子数为a,中子数为b,则X的质量数为:a-b |
| B.若弱酸HA的酸性强于弱酸HB,则同物质的量浓度钠盐溶液的碱性比较为:NaA<NaB |
| C.若R2-和M+的电子层结构相同,则原子序数的比较为:R>M |
| D.若反应A2+2D—==2A-+D2能发生,则氧化性的比较为:D2>A2 |
有平衡体系:CO(气) + 2H2(气)  CH3OH(气) ;ΔH<0为了增加甲醇的产量,工厂应采取正确的措施是
CH3OH(气) ;ΔH<0为了增加甲醇的产量,工厂应采取正确的措施是
| A.高温、高压 | B.适宜的温度、高压、催化剂 |
| C.低温、低压 | D.低温、低压、催化剂 |
已知2Fe3++2Br-=2Fe2++ Br2,当把Cl2通入FeBr 2溶液中时,下列离子方程式一定不正确的是
| A.Cl2+2Br-= Br2+2Cl- |
| B.4Cl2+6Br-+2Fe2+=2Fe3++3Br2+8Cl- |
| C.3Cl2+2Fe2++4Br-=2Fe3++2Br2 +6Cl- |
| D.2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl- |
下列各项中的两个量,其比值一定为2:1的是
| A.液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体 |
| B.在碳与浓硫酸的反应中,还原产物与氧化产物的物质的量 |
| C.1mol Na2O2与1molNa2O中的阴离子数目 |
| D.相同温度下,0.2mol/L醋酸溶液和0.1mol/L醋酸溶液中c(H+) |