写出下列物质的电子式:①KCl ;②Cl2 ;③H2O 。
镇痉药物C、化合物N以及高分子树脂 的合成路线如下:
的合成路线如下:
( 代表烃基)
(1)
的含氧官能团的名称是。
(2)
在催化剂作用下可与
反映生成
。该反应的反应类型是。
(3)酯类化合物
的分子式是
,其结构简式是。
(4)
发生银镜反应的化学方程式是。
(5)扁桃酸 由多种同分异构体。属于甲酸酯且含酚羟基的同分异构体共有种,写出其中一种含亚甲基
由多种同分异构体。属于甲酸酯且含酚羟基的同分异构体共有种,写出其中一种含亚甲基 的同分异构体的结构简式。
的同分异构体的结构简式。
(6)
与
合成高分子树脂的化学方程式是。
(7)
在
溶液中发生水解反应的化学方程式是。
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。
试验过程:
Ⅰ.打开弹簧夹,打开活塞
,滴加浓盐酸。
Ⅱ.当
和
中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当
中溶液由黄色变为棕色时,关闭活塞
。
Ⅳ………
(1)
中产生黄绿色气体,其电子式是。
(2)验证氯气的氧化性强于碘的实验现象是。
(3)
中溶液发生反应的离子方程式是。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是。
(5)过程Ⅲ实验的目的是。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,得电子能离逐渐减弱。
某氮肥厂氨氮废水中的氮元素多以
和
的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加
溶液,调节
至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加
溶液的作用:。
②用化学平衡原理解释通空气的目的:。
(2)过程Ⅱ:在微生物作用的条件下,
经过两步反应被氧化成
。两步反应的能量变化示意图如下:
①第一步反应是反应(选题"放热"或"吸热"),判断依据是。
②1
全部氧化成
的热化学方程式是。
(3)过程Ⅲ:一定条件下,向废水中加入
,将
还原成。若该反应消耗
转移6
电子,则参加反应的还原剂和氧化剂的物质的量之比是。
由短周期元素组成的化合物
是某抗酸药的有效成分。甲同学欲探究
的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝。
②
在
=5.0时沉淀完全;
在
=8.8时开始沉淀,在
=11.4时沉淀完全。
实验过程:
Ⅰ.向化合物
粉末中加入过量盐酸,产生气体
,得到无色溶液。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调节
至5~6,产生白色沉淀
,过滤。
Ⅳ.向沉淀
中加过量
溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加
溶液,调节
至12,得到白色沉淀
。
(1)Ⅰ中气体
可使澄清石灰水变浑浊,
的化学式是。
(2)由Ⅰ、Ⅱ判断
一定不含有的元素是磷、。
(3)Ⅲ中生成
的离子方程式是。
(4)Ⅳ中
溶解的离子方程式是。
(5)沉淀
的化学式是。
(6)若上述
:
:
=1:2:3,则
的化学式是。
是新型降压药替米沙坦的中间体,可由下列路线合成:
(1)
的反应类型是,
的反应类型是,
的反应类型是。
(2)写出满足下列条件的B的所有同分异构体(写结构简式)。
①含有苯环②含有酯基③能与新制
反应
(3)
中含有的官能团名称是。已知固体
在加热条件下可溶于甲醇,下列
的有关说法正确的是。
a.使用过量的甲醇,是为了提高D的产率 b.浓硫酸的吸水性可能会导致溶液变黑
c. 甲醇既是反应物,又是溶剂 d. D的化学式为
(4)E的同分异构体苯丙氨酸经聚合反应形成的高聚物是(写结构简式)。
(5)已知 在一定条件下可水解为
在一定条件下可水解为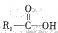 和
和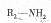 ,则F在强酸和长时间加热条件下发生水解反应的化学方程式是。
,则F在强酸和长时间加热条件下发生水解反应的化学方程式是。