可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
| A.1个N≡N键断裂的同时,有3个H—H键断裂 |
| B.N2、H2、NH3的分子数之比为1︰3︰2 |
| C.反应体系中N2和NH3的物质的量之比不变 |
| D.3v正(H2)=2v逆(NH3) |
如果把Cu、Zn与稀H2SO4构成的原电池表示为 ,则下列能表示原电池的是
,则下列能表示原电池的是
A.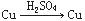 |
B.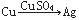 |
C.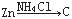 |
D. |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl﹣﹣e﹣=AgCl |
| B.每生成1mol Na2Mn5O10转移2mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
| A.用一定量NaOH稀溶液和稀盐酸反应测得的中和热数据,来推算一定量的稀H2SO4和NaOH稀溶液反应的反应热 |
| B.用沸点数据推测能否用蒸馏的方法将两种液体混合物进行分离 |
| C.用反应热数据的大小判断不同反应的反应速率大小 |
| D.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性的强弱 |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
| A.NH4HCO3和盐酸的反应是放热反应 |
| B.该反应中,热能转化为产物内部的能量 |
| C.反应物的总能量高于生成物的总能量 |
| D.断裂旧化学键吸收的总能量小于形成新化学键放出的总能量 |
NA为阿伏加德罗常数,下列有关说法正确的是
| A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA |
| B.4℃时,18g2H216O中含有共用电子对数为2NA |
| C.用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA |
| D.1mol N5+含有的电子数为34NA |