(12分)回答下列问题
(1)CH4、CO2、COCl2和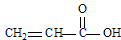 四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
四种分子中,碳原子为sp2杂化的分子是_______________________________________________。
(2)NH3分子的立体构型是___________形,联氨(N2H4)可视为是NH3分子中的一个氢原子被氨基(-NH2)取代所形成的物质,写出联氨加入足量盐酸反应的化学方程式_________________________________________________________________。
(3)H2O、H2O2、OF2和SCl2四种分子中各原子均达8电子结构的分子是________________。
(4)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g) ,若该反应中有4 mol N—H键断裂,则形成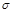 键有_______mol和形成
键有_______mol和形成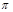 键有_______mol。
键有_______mol。
(5)H2O熔沸点都比H2S高,其原因是___________________________________________。
乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:
回答下列问题:
(1)A的结构简式为 。
(2)B的化学名称是 。
(3)由乙醇生产C的化学反应类型为 。
(4)E是一种常见的塑料,其化学名称是 。
(5)由乙醇生成F的化学方程式为 。
及其盐都是重要的化工原料。
(1)用
和
制备
,反应发生、气体收集和尾气处理装置依次为。
(2)按下图装置进行
性质实验。
①先打开旋塞1,
瓶中的现象是,原因是,稳定后,关闭旋塞1。
②再打开旋塞2,
瓶中的现象是。
(3)设计实验,探究某一种因素对溶液中
水解程度的影响。
限制试剂与仪器:固体
、蒸馏水、100
容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、
计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究对溶液中
水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中
(溶液)表示所配制溶液的体积)。
| 物理量 实验序号 |
(溶液)/ | …… |
|||
| 1 |
100 |
||||
| 2 |
100 |
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为 ,则 水解反应得平衡转化率为(只列出算式,忽略水自身电离的影响)。
七铝十二钙(12
·7
)是新型的超导材料和发光材料,用白云石(主要含
和
)和废
片制备七铝十二钙的工艺如下:
(1)煅粉主要含
和,用适量的
溶液浸取煅粉后,镁化合物几乎不溶, 若溶液I中
(
)小于5×10-6
,则溶液
大于(
的
=5×10-12);该工艺中不能用
代替
,原因是。
(2)滤液I中的阴离子有(忽略杂质成分的影响);若滤液I中仅通入
,会生成,从而导致
产率降低。
(3)用
溶液可除去废
片表面的氧化膜,反应的离子方程式为。
(4)电解制备
时,电极分别为
片和石墨,电解总反应方程式为。
(5)一种可超快充电的新型铝电池,充放电时
和
两种离子在
电极上相互转化,其它离子不参与电极反应,放电时负极
的电极反应式为。
用
将
转化为
,可提高效益,减少污染,
(1)传统上该转化通过如图所示的催化剂循环实现,
其中,反应①为: △H1反应②生成 的反应热为△H2,则总反应的热化学方程式为__________(反应热用△H1和△H2表示)。
(2)新型
催化剂对上述
转化为
的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的
平衡转化率随温度变化的aHCl-T曲线如图,则总反应的△H0(填">"、"﹦"或"<");A、B两点的平衡常数K(A)与K(B)中较大的是__________。

②在上述实验中若压缩体积使压强增大,画出相应aHCl-T曲线的示意图,并简要说明理由__________。
③下列措施中有利于提高aHCl的有__________。
A、增大n(
)B、增大n(
)
C、使用更好的催化剂 D、移去
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t(min) |
0 |
2.0 |
4.0 |
6.0 |
8.0 |
| n(Cl2)/10-3mol |
0 |
1.8 |
3.7 |
5.4 |
7.2 |
计算2.0~6.0min内以
的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程)。
(4)
用途广泛,写出用
制备漂白粉的化学方程式。
"张-烯炔环异构反应"被《
》收录。该反应可高效构筑五元环化合物:
(
表示氢、烷基或芳基)
合成五元环有机化合物
的路线如下:
(1)
属于炔烃,其结构简式是。
(2)
由碳、氢、氧三种元素组成,相对分子质量是30。
的结构简式是
(3) 含有与 相同的官能团, 是芳香族化合物, 中含有的官能团是
(4) 与试剂 反应生成 的化学方程式是 ;试剂 是。
(5) 和 均为不饱和醇。 的结构简式是
(6) 为顺式结构,写出 和 生成I(顺式结构)的化学方程式:。