有甲、乙、丙、丁四种金属,将甲、乙用导线相连放人稀硫酸中可以看到乙慢慢溶解,而甲的表面有气泡逸出;把丁放到乙的硝酸盐溶液中后,丁表面覆盖一层乙的单质;用石墨电极电解含有相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出;将甲放入稀盐酸中有H2析出,已知四种金属中有一种是铜,根据以上实验判断铜是( )
A 甲 B 乙 C 丙 D 丁
已知酸性高锰酸钾溶液可以将FeSO4氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是
| A.方程式中的X为2MnSO4 |
| B.氧化性:KMnO4>Fe3+>I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol |
| D.AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-===2Fe2++I2 |
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
已知转化过程中的反应为
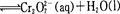
转化后所得溶液中铬元素的含量为28.6 g/L, CrO42-有10/11转化为Cr2072-,下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B.若用绿矾(FeS04·7H2O)作还原剂,处理1 L废水,至少需要458.7g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 |
| D.常温下Ksp=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
下列图示与对应的叙述不相符的是
A.图甲表示反应:4CO(g)+2NO2(g) N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 |
B.图乙表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强比甲的压强大 3C(g)+D(g)的影响,乙的压强比甲的压强大 |
| C.图丙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变 |
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述不正确的是
| A.b、c两点溶液的导电能力不相同 |
| B.a、b、c三点溶液中水的电离程度a>c>b |
| C.c点溶液中C(H+) + C(CH3COOH)= C(OH-) |
| D.用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc |
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
| A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解 |
| B.若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O |
| C.该电池使用过程中需补充Li2CO3和K2CO3 |
| D.空气极发生的电极反应式为O2+4e-+2CO2===2CO |