A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为_______;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氖相同,B的元素符号为________,C的元素符号为________;
(3)D元素的正二价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为_________ _____,它位于第______周期第______族;
(4)E元素基态原子的M层能量最高的能级半充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为________ ______。
化合物A(C6H6O)是一种重要的有机化工原料,A 的有关转化反应如下(部分反应条件略去):
已知: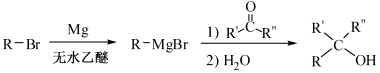
(R表示烃基,R′和R″表示烃基或氢)
(1)写出A 的结构简式:。
(2)G是常用指示剂酚酞。写出G的分子式。
(3)某化合物是E的同分异构体,且分子中只有两种不同化学环境的氢。写出该化合物结构简式:(任写一种)。
(4)F和D互为同分异构体。写出反应E→F的化学方程式:。
(5)结合相关信息,写出以A和HCHO为原料制备 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
二茂铁(如图)是一种有机过渡金属化合物,不溶于水,易溶于苯、乙醚等有机溶剂。由烃A可制备二茂铁。A分子是一种没有侧链的环状结构,其一氯取代物有三种,1molA最多可与2molBr2加成,其与Br2的1:1加成只得两种产物。
(1)A的结构简式为。
(2)下列说法正确的是。
| A.烃A具有烯烃的性质 | B.烃A具有苯的性质 |
| C.烃A分子中所有的碳原子可能在同一平面 | D.烃A不可能发生取代反应 |
(3)写出A的1,4-加成聚合反应的化学方程式
二茂铁氯乙酰是有机合成的中间体,下面是其合成路线:
(4)写出有关物质的化学式:试剂A,C(结构简式)。
(5)B→C的反应类型是,最终合成二茂铁乙酰氯的反应类型是。
(6)写出C与足量NaOH溶液反应的化学方程式:。
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。
已知:3Cl2+2NH3→N2+6HCl――① 3Cl2+8NH3→N2+6NH4Cl――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→――③
(5)反应③中的还原剂是,还原产物是。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是mol。
X、Y、Z、M、N是五种短周期元素,原子序数依次增大。X原子中没有中子,Y元素最高正价与最低负价之和为0;M与X同主族;Z、N分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) ,M离子的电子排布式为。
由以上某些元素组成的化合物A、B、C、D有如下转化关系
其中C是溶于水显酸性的气体;D是淡黄色固体。
(3)写出C的结构式;D的电子式
(4)如果A、B均由三种元素组成,B为两性不溶物,写出由A转化为B的离子方程式
(5)如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因。
(6)如果将27题中A、B浓度均为0.1mol/L的溶液混合,混合溶液中离子浓度由大到小的顺序是。
已知:
芳香烃A能发生下面一系列转化:
完成下列填空:
(1)反应类型:②_______,③_______;
(2)结构简式 A _______,G _________;
(3)反应的化学方程式:
①_________________________________________________
⑤__________________________________________________
(4)上述流程中的物质,互为同分异构体的是________________(选填编号);
(5)写出由A转化为 的线路。(用A→ …… →目标产物 在箭号上写明反应试剂及反应条件。)。
的线路。(用A→ …… →目标产物 在箭号上写明反应试剂及反应条件。)。