氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
(1)由B2O3制备BN、BF3的化学方程式依次是______ ___、
___ _______;
(2)BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为____ ___;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为_____ _,层间作用力为____ ____;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是____ ___g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
5000C下发生如下反应H2(g)+CO2(g) H2O(g)+CO(g)△H<0,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。(已知此温度下该反应的平衡常数K=
H2O(g)+CO(g)△H<0,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。(已知此温度下该反应的平衡常数K= )
)
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
(1)、平衡时,甲中CO2转化率为
在甲、乙、丙三个恒容密闭容器中CO2转化率大小比较
(2).丙中达平衡需要20S,则反应速率V(CO2)=
(3).甲中的反应速率-时间图像如图,在图中画出丙的反应速率-时间图像
(4)升高温度,平衡常数K (填 “大于”“小于”“等于”)
(填 “大于”“小于”“等于”)
.A、B、C、D为常见气态单质。已知:① A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子E、F中都含有10个电子;
③C和D反应生成的化合物J易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀。
(1)E与J按物质的量2:1通入F中得到的溶液中存在的四个平衡体系,(用方程式表示):
已知该溶液呈碱性,溶液中离子浓度由大到小的顺序为
(2)A、C、D所含元素可组成一种离子化合物R,该化合物R在重水D2O中发生水解反应的化学方程式是。
(1)常温下有PH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,比较盐酸、HX、HY、HZ四种酸酸性由强到弱
(2)已知25°C时:

氢氟酸是一种弱酸,可用来刻蚀玻璃。20ml0.1mol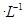 的氢氟酸与0.1mol/L
的氢氟酸与0.1mol/L
氢氧化钠溶液完全反应时放热aJ,写出氢氟酸电离的热化学方程式
A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素。
已知
(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是(填序号)。
(2)G生成B的过程中所出现的现象;
反应③的离子方程式。
(3)D的水溶液显酸性,请用离子方程式解释原因。
(4)实验室制取C的化学方程式为;
对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023 个。请按照要求填空:
| 实验步骤 |
实验现象 |
用化学用语解释 |
| 将少量气体通入淀粉KI溶液 |
溶液最初变成色 |
(用离子方程式表示) |
| 继续通入气体 |
溶液逐渐变成无色 |
(用化学方程式表示) |
现有等物质的量的NaHCO3、KHCO3的混合物a g与100mL盐酸反应。题中涉及的气体体积均以标准状况计,填空时可以用带字母的公式表示。
(1)该混合物中NaHCO3与KHCO3的质量比为。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为mol·L-1。
(3)如果盐酸过量,生成CO2的体积为L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积范围是。