一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
⑴在人体中进行的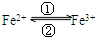 转化时,②中的Fe3+作 剂;
转化时,②中的Fe3+作 剂;
⑵ “服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作 剂,具有 性。
⑶市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为 。
图中电极a、b分别为Ag电极和Pt电傲,电极c、d都是石墨电极。通电一段时间后,在c、d两极共收集到336mi。(标准状况)气体,其体积比为l:2。回答:
(1)直流电源中,M为极。
(2)b电极上的电极反应方程式,c电极上的电极反应方程式。
(3)通电一段时间,AgNO3溶液的pH(填”增大”、”减小”或”不变”。)。
(4)若通电一段时间后H2SO4溶液的质撮分数由5.00%变为5.02%,则原5.00%,的H2SO4溶液为g。(保留三位有效数字)
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答: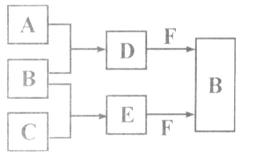
(1)E的结构式是。
(2)单质X和B或D在一定条件下均能反应生成黑色磁性固体Y,X与D生成Y的化学方程式是。
(3)物质Z与B互为同素异形体,它常用于对空气进行杀菌、净化和水果保鲜等 。Z和酸性碘
。Z和酸性碘 化钾溶液反应生成B和碘单质,反应的离子方程式是。
化钾溶液反应生成B和碘单质,反应的离子方程式是。
(4)E和H2可用于合成CH3OH和H2O,每4.4gE参与反应放热13.09kJ。在25℃,101 kPa时,该反应的热化学方程式是。
(5)取0.3 mol F与足量D充分混合后,再通入0.4 mol E恰好完全被吸收,所得溶液中各种离子的浓度由大到小的顺序是。
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有ⅥA族和几种元素的位置。请回答下列问题: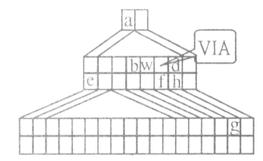
(1)g元素在周期表中的位置。元素a和w形成的化合物wa3是分子(填 ”极性”或”非极性”)。
”极性”或”非极性”)。
(2)d的氢 化物的沸点比h的氢
化物的沸点比h的氢 化物的沸点,(填”高”、”低”或”相等”)原因是。
化物的沸点,(填”高”、”低”或”相等”)原因是。
(3)用电子式表示化合物eh的形成过程。
(4)b和w可形成一种原子晶体,它的用途有,(答一种即 可)由化合物b(wa2)4在高温下分解可生成wa,和该原子晶体。则该原子晶体的化学式为。
可)由化合物b(wa2)4在高温下分解可生成wa,和该原子晶体。则该原子晶体的化学式为。
由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如 :
:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式;
(2)CCl4分子中C原子采取杂化成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是,其中碳氧原子之间共价键是 (填序号):
(填序号):
a.2个σ键b.2个π键c.1个σ键、1个π键
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是。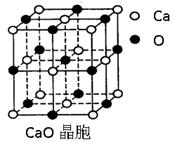
在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g)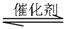 CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下
CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下 表:
表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。该反应为反应(选填“吸热”、“放热”)。
(2)能判断该反应是否达到化学平衡状态的依据是。
(a)容器中压强不变(b)混合气体中c(CO)不变
(c)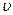 逆(H2)=
逆(H2)=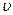 正(H2O)(d)c(CO2)=c(CO)
正(H2O)(d)c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积。平衡移(选填“向正反应方向”、“向逆反应方向”、“不”)
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,CO的转化率为。