煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)=2CO2(g) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
则反应CO(g)+2H2(g)=CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。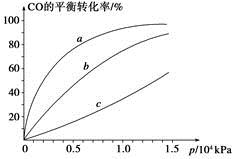
③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g) CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g) CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
A.平衡常数 B.CH3OH的平衡浓度
C.达到平衡的时间 D.平衡时气体的密度
下表为元素周期表的一部分,针对表中①~⑥元素,回答下列问题
| ① |
② |
||||||||||||||
| ③ |
④ |
⑤ |
⑥ |
(1)②元素在周期表中的位置是第二周期族
(2)写出①的最高价氧化物的电子式
(3)⑤和⑥两种元素的最高价氧化物对应水化物中酸性较强的是(填化学式)
(4)写出④的单质和③的最高价氧化物的水化物反应
(1)写出甲烷发生一氯取代反应的化学方程式
(2)写出苯和浓硝酸、浓硫酸混合液在50 ~ 60℃时发生反应的化学方程式
如右图所示,在试管a中先加3mL乙醇,边摇动边缓缓加入2mL浓硫酸,摇匀冷却后,再加入2ml冰醋酸,充分搅动后,固定在铁架台上。在试管b中加入适量的A溶液。连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验。
(1)右图所示的装置中,装置错误之处是:;
(2)A是溶液;(3)加入浓硫酸的作用是:、;
(4)乙酸跟乙醇在浓硫酸存在并加热和条件下发生的酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(Ⅰ)这一步
如果将反应按加成、消去、取代反应分类,则A—F个反应中(将字母代号填入下列空格中),属于取代反应的是;属于加成反应的是;属于消去反应的是。
请写出下列物质的化学用语:
①葡萄糖的结构简式:
②乙醛与新制氢氧化铜溶液氢氧化钠存在下发生反应的化学方程式为:;
③溴乙烷和氢氧化钠的乙醇溶液共热的反应方程式为:
④石炭酸和足量的氢氧化钠溶液反应化学方程式:
某厂废水中含5.00×10-3mol·L-1的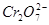 ,其毒性较大。某研究性学习小组为了变
,其毒性较大。某研究性学习小组为了变
废为宝,将废水处理得到磁性材料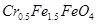 (
(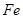 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:


 (1)第①步反应的离子方程式是,
(1)第①步反应的离子方程式是,
(2)第②步中用PH试纸测定溶液PH的操作方法是:
,
(3)第③步过滤得到的滤渣中主要成分除Cr(OH)3外,还有,
(4)欲使1L该废水中的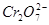 完全转化为
完全转化为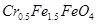 。理论上需要加入
。理论上需要加入
克FeSO4·7H2O。