面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。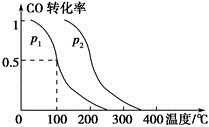
①p1________p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下同),平衡常数________。
(3)已知在T ℃时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
此时刻v正________v逆(填“>”或“<”)。
KMnO4是一种重要的氧化剂。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是。
a.硝酸 b.硫酸 c.盐酸
②将 氧化C2O42−的离子方程式补充完整:
氧化C2O42−的离子方程式补充完整:
□MnO4−+□C2O42−+□==□Mn2+ +□CO2↑+□。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
| 滴入KMnO4溶液的次序 |
KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 |
60 s |
| 褪色后,再滴入第2滴 |
15 s |
| 褪色后,再滴入第3滴 |
3 s |
| 褪色后,再滴入第4滴 |
1 s |
请分析KMnO4溶液褪色时间变化的可能原因。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为。
氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是。
(2)实验室用MnO2与浓盐酸反应制取氯气的原理如下:MnO2 + 4HCl MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
①若制取11.2 L Cl2(标准状况),则最少应加入MnO2的质量为______g。
②用平衡移动原理解释可用排饱和食盐水法收集氯气的原因。(结合必要的化学用语及文字回答)
③制备氯气时,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a. KI溶液 b. FeCl2溶液 c. KCl溶液
写出你选择的吸收试剂与Cl2反应的离子方程式:_______。
④也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是_______。
桂醛在医药、化工、香料、食品等领域应用广泛。合成桂醛并用桂醛合成聚酯F的路线如下图所示。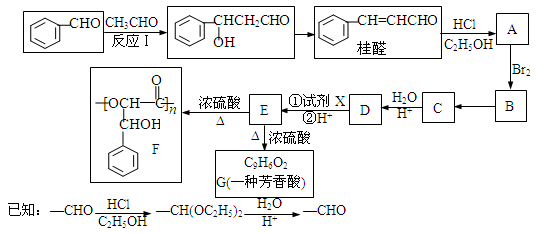
根据题意完成下列填空:
(1)写出反应类型。反应B→C;反应E→G。
(2)写出结构简式。C;G。
(3)若试剂X为新制氢氧化铜悬浊液 ,则该反应的条件是,反应现象是 _____________________ 。
(4)在浓硫酸、加热的条件下E生成F的同时有少量的G以及环酯生成,写出这种环酯一种可能的结构简式。
(5)请写出同时满足下列条件的桂醛的所有同分异构体的结构简式。
a.分子中不含醛基和羟基 b.苯的对二取代物 c.除苯环外,不含其它环状结构
(6)上述反应得到的桂醛中含有少量分子式为C11H12O2的化合物,该物质是由桂醛和乙醛发生了类似反应Ⅰ的反应生成的。写出桂醛和乙醛生成C11H12O2的化学方程式。
溴水中存在下列平衡:Br2+H2O HBr+HBrO有机反应往往比较复杂,伴随副反应发生。已知X经加成反应可能生成产物A、D,请根据下列流程填空。
HBr+HBrO有机反应往往比较复杂,伴随副反应发生。已知X经加成反应可能生成产物A、D,请根据下列流程填空。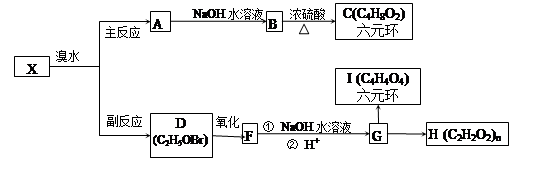
(1)A→B的反应类型为_____________,写出C的结构简式_________________;
(2)有C的同分异构体M,既能发生银镜反应,也能发生酯化反应,M有_____种同分异构体,写出其中分子结构中有支链的分子的结构简式___________________,
(3)写出下列有机物的结构简式: F_________________,I______________;
(4)完成G→H化学方程式:
__________________________________________;
(5)完成X→D化学方程式__________________________________________;
(6)X与溴水的反应中还存在一种有机副产物,其结构简式为__________________。
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应: 2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)
在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。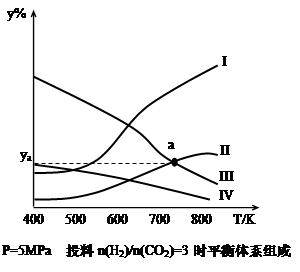
完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是_______(选填序号)
(2)在一定温度下反应达到平衡的标志是_______(选填编号)
a.平衡常数K不再增大
b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.反应物不再转化为生成物
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是_______(选填编号);达到平衡后,能提高H2转化率的操作是_______(选填编号)
a.降低温度 b.充入更多的H2
c.移去乙醇 d.增大容器体积
(4)图中曲线II和III的交点a对应的体积分数ya=_______%