若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是( )
| A.利用太阳能蒸馏海水 |
| B.加入明矾,使海水中的盐分沉淀淡化 |
| C.将海水通过离子交换树脂,以除去所含盐分 |
| D.利用渗析法使海水淡化 |
在恒容密闭器中通入物质的量浓度均0.1 mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是()
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图,下列有关说法一定正确的是()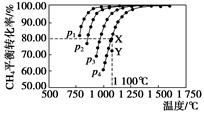
| A.上述反应的ΔH>0 |
| B.压强p1>p2>p3>p4 |
| C.1 100 ℃该反应的平衡常数为64 |
| D.压强为p4时,在Y点:v(正)<v(逆) |
一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是()
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是()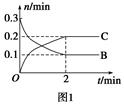
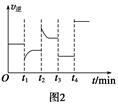
A.x=2,反应开始2 min内v(B)=0.1 mol·L-1·min-1
B.t1时是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
一定温度下,在2 L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
2N2O5(g);已知该反应的平衡常数:K300 ℃>K350 ℃,且n(NO2)(单位:mol)随时间变化如下表:
| 时间(s) |
0 |
500 |
1000 |
1500 |
| t1℃ |
20 |
13.96 |
10.08 |
10.08 |
| t2℃ |
20 |
a |
b |
c |
下列说法一定正确的是()
A.正反应为吸热反应
B.如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1 000 s至1 500 s之间
D.如果t2℃>t1℃,那么b>10.08
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是()
| A.电池放电时Na+从b极区移向a极区 |
| B.每消耗3 mol H2O2,转移的电子为3 mol |
| C.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D.该电池的负极反应为BH4-+8OH--8e-=BO2-+6H2O |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是()
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是()
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应:CH3OH(l)+ O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |