某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯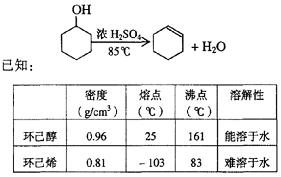

(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70 ℃开始收集产品 b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
实验室常用下列装置制备、收集二氧化氮气体,并探究其性质。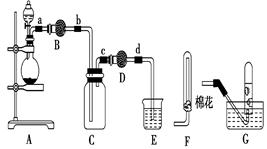
(1)装置A中的分液漏斗里盛装的液体通常是,圆底烧瓶中预先加入的是铜片,但铁的价格比铜的价格低,此处用铜片不用铁片的原因是。
(2)干燥管D中装的干燥剂是无水氯化钙,其作用是 。
(3)随着时间的推移,浓硝酸逐渐变稀,装置E的作用是吸收尾气,吸收过程中发生反应的化学方程式如下:2NO2+2NaOH=NaNO3+NaNO2+H2O ;NO2+NO+2NaOH=2NaNO2+H2O
①NO和NO2混合气体的组成可表示成NOx,该混合气体通入NaOH溶液被完全吸收时,x的值可以为 (填字母)
| A.1.1 | B.1.2 | C.1.5 | D.1.8 |
②现有2.4mol NO2和1.2mol NO组成的混合气体,要用NaOH溶液使其完全吸收,最终无气体剩余。现有浓度为1mol/L的NaOH溶液,则需此NaOH溶液的体积至少是L。
(4)在上述装置中,若改用其它收集装置,最后收集到的气体中无NO2气体,则采用的收集装置是(选填“F”或 “G”)。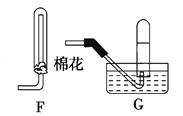
某研究性学习小组在实验室中配制0.20mol·L-1的盐酸标准溶液,然后用其滴定某未知浓度的氢氧化钠溶液。
⑴配制待测液:将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要玻璃仪器除烧杯,200 mL容量瓶,量筒,还有﹑。
⑵滴定:
①盛装0.20mol·L-1盐酸标准液应该用式滴定管,
②滴定时,先向锥型瓶中加酚酞作为指示剂;再逐滴滴定,观察到时为滴定终点。
③有关数据记录如下:
| 滴定序号 |
待测液体体积(mL) |
所耗盐酸标准液的体积(mL) |
|
| 起始读数 滴定前 |
终点读数 |
||
| 1 |
20.00 |
0.50 |
20.40 |
| 2 |
20.00 |
6.00 |
26.10 |
| 3 |
20.00 |
4.00 |
24.00 |
数据处理:NaOH溶液的浓度为mol·L-1,烧碱样品的纯度为。(保留三位有效数字)
⑶试分析以下各项操作对实验结果的可能影响,用“偏高”﹑“偏低”或“无影响”等填空:
①若用蒸馏水冲洗锥形瓶,则会使测定的结果;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果;
④读数时,若滴定前俯视读数,滴定后仰视读数,则会使测定结果;
课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
如图甲是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的证明CO具有还原性的实验装置。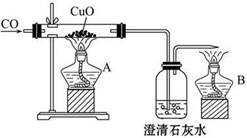
甲
(1)实验时应先点燃_____________(填“A”或“B”)处的酒精灯。
(2)硬质玻璃管中反应的化学方程式为__________________________________。
(3)乙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理。如图乙是他设计的贮气瓶,尾气应从__________(填“a”或“b”)口通入(其他装置略)。
乙
(4)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应,试对此作出评价。你认为丙的设计是否有必要?____________,理由是________________。
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的?_________________________________________________。
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: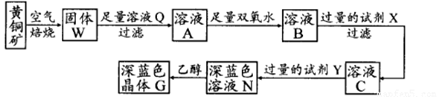
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表: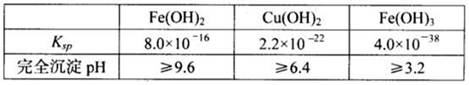
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式;
(2)试剂X的化学式为,双氧水的作用是;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为,用pH试纸测该溶液pH值的方法是;
(4)在溶液N中加入乙醇的目的是。
某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验: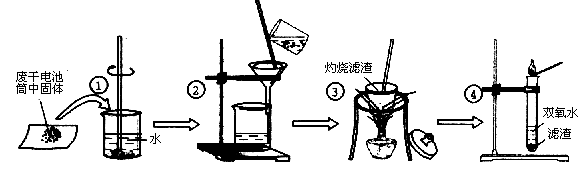
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作①的名称是;
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、、泥三角和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有。
(3)往操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为, 操作④相关的化学方程式为。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4+,该同学取少许滤液于试管中(填写操作与现象),则证实滤液中含有NH4+。
(5)该同学利用在废旧干电池中回收的Zn片和石墨电极,设计一个原电池实验,比较铜与锌的金属活动性强弱。
限用材料:铜片、锌片、石墨电极、稀硫酸、CuSO4溶液、ZnSO4溶液;
限用仪器:直流电源、电流计、导线、烧杯、试管、盐桥等中学化学常见的药品和仪器
请画出实验装置图,并作相应标注,同时写出正极方程式。