某实验小组的同学在加热铜与浓硫酸的混合物实验时,发现生成了一种无色有刺激性气味的气体和蓝色溶液,进行如下探究活动.
[查阅资料]①某些不活泼的金属(如铜)能与一些强氧化性的酸(如浓硫酸)发生反应,生成水而不生成氢气,同时生成二氧化硫和铜盐.
②硫酸铜溶于水后,溶液呈酸性.
[知识回顾]铜、银_______(能、不能)与稀硫酸、盐酸反应产生氢气.
[分析讨论]⑴对于生成的蓝色溶液,小东认为可能是Cu(NO3)2溶液,小楠认为不可能是Cu(NO3)2溶液,而可能是硫酸铜溶液,小楠的理由是 .
⑵写出铜与浓硫酸共热的化学方程式 .
⑶小东根据化学方程式说,该方法适用于以铜为原料大量制取硫酸铜,小田认为不适宜,你能说出小田的一个理由吗 .
[提出问题]上述蓝色溶液中有无硫酸剩余?
[实验论证]小坤认为可向蓝色溶液中滴加氯化钡溶液,观察有无沉淀产生,经大家讨论后,该方案被否定,你觉得否定该方案的理由是 .
[反思评价]⑴有同学提问:为什么不可以用石蕊试液来进行检验?你的回答是 .
⑵同学们发现:将足量的铜和足量的浓硫酸置于容器中加热,一段时间后,反应会逐渐变慢,最后反应停止,你能说出反应停止的原因吗? .
根据下列实验装置图回答问题:
(1)写出
的仪器名称;
(2)实验室制备和收集
的装置组合是(填字毋序号);写出此套装置制备
对应的化学方程式:;
(3)用B装置制取
时检查气密性的方法是;
(4)氢气是一种无色.无味、难溶于水的气体,其密度比空气的密度小,在实验室中常用锌粒和稀硫酸反应制取.
①实验室制取氢气的发生装置是(填字毋序号);
②氢气与氧气混和点燃可能会发生爆炸,因此点燃之前必须先.
(1)用石蕊染成紫色的干燥纸花,进行如下操作,能够观察到纸花变红的是.
(2)下列
是探究物质性质的实验:
二氧化碳是否可以溶于水,很难直接观察到现象,可以通过
中塑料瓶的变化来间接感知.同样,研究氢氧化钠溶解于水时是吸热还是放热,可利用密闭的广口瓶内的变化引起
形管内水位的变化,若(填
或
)处的水位升高,则是放热.
(3)一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分,取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察.下表是实验中可能出现的现象与对应结论,请你填写下表中空白处的相关内容:
| 现象 |
结论 |
| |
含 |
| 溶液颜色无明显变化,有黑色不溶物 |
只含 |
通过实验及分析,确定该粉末为氧化铜和碳粉混合物,为了进一步探究它们的性质,探究小组又利用这种混合物补充做了如图所示实验:
①试管
中的化学方程式为.
②氧化铜和碳反应属于反应.(填基本反应类型)
③最能说明
试管中氧化铜和碳已完全反应的实验现象是.
人教版新课标化学教材九年级上册(2012教育部审定)"分解过氧化氢制氧气的反应中二氧化锰的催化作用",以及"寻找新的催化剂"研究性实验,引起了化学探究小组的兴趣.
【实验探究】
| 实验步骤 |
实验现象 |
| Ⅰ.分别量取5
5%过氧化氢溶液放入
、
两支试管中,向
试管中加入
氧化铁粉末,并分别在
、
两支试管中插入带火星木条,观察现象. |
试管中产生气泡,带火星木条复燃,
试管中无明显现象 |
| Ⅱ.待
试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次实验,观察现象. |
试管中均产生气泡,带火星木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得虑渣进行洗涤、干燥、称量,所得固体质量仍为
. |
|
| Ⅳ.分别量取5
5%过氧化氢溶液放入
、
两支试管中,向
试管中加入
氧化铁粉末.向
试管中加入
二氧化锰粉末,观察现象. |
【实验结论】
(1)
中产生的气体是;
(2)实验Ⅱ、Ⅲ证明:氧化铁的和在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的化学方程式.
【实验评价】
(1)设计实验Ⅳ的目的是;
(2)若实验Ⅳ观察到
试管中产生气泡的速率更快,由此你可以得到的结论是.
【实验拓展】
查阅资料得知:
、
、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂.下列有关催化剂的说法中正确的是.
| A. |
只能作为氧化氢溶液分解的催化剂 |
B. |
同一个化学反应可以有多种催化剂 |
C. |
催化剂只能加快化学反应的速率 |
D. |
用作催化剂的物质不可能是其它反应的反应物或生成物 |
E. |
酶是一种重要的生物催化剂,它属于糖类 |
化学兴趣小组同学发现实验台上按如图所示顺序摆放着6瓶不同的无色溶液(如图所示:A、B、C、D、E、F代表对应的溶液).其中E溶液的试剂瓶标签破损.为此,他们做了如下探究: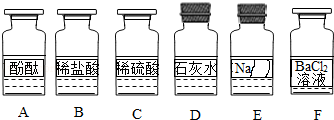
【提出问题】E溶液的成分是什么?
【初步判断】根据受损标签及实验室药品分类摆放原则,E溶液不可能是(填序号).①酸;②碱;③盐.
【提出猜想】猜想Ⅰ:
溶液;猜想Ⅱ:
溶液;猜想Ⅲ:
溶液;猜想Ⅳ:溶液(任写一种).
【设计并实验】兴趣小组的同学为验证"猜想Ⅱ"是否正确,设计并完成如下表所示实验.
| 实验方案 |
实验一 |
实验二 |
实验三 |
| 实验操作 |
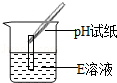 |
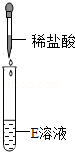 |
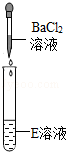 |
| 实验现象 |
试纸变色,对照比色卡,pH>7 |
有无色无味气体产生 |
|
| 实验结论 |
猜想Ⅱ正确 |
【分析与推理】
①完成"实验一"后,李成同学即认为"猜想Ⅰ"正确,张平同学认为"猜想Ⅰ"不一定正确,他的理由是.
②何刚同学认为只需要完成"实验二"即可得出"猜想Ⅱ"正确的结论,你认为该说法(填"合理"或"不合理"),理由是.
③请写出"实验三"中发生反应的化学方程式.
【反思与评价】
经过讨论,同学们认为"实验一"存在明显操作错误,该错误是;观察发现D、E试剂瓶的瓶塞是橡胶塞,使用橡胶塞的原因是.
某研究学习小组对“NaOH溶液与稀H2SO4溶液是否恰好反应”进行实验探究.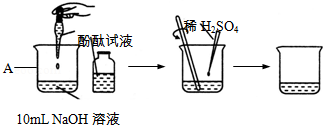
(1)如图是类似教材所示酸与碱反应的实验过程.
①图中仪器A的名称是 .
②向A中加入10mLNaOH溶液,并滴入3滴酚酞试液,再向其中慢慢滴入稀硫酸,并用玻璃棒不断 ,使溶液混合均匀,直至溶液的颜色由红色恰好变成 色为止,表明两者发生了反应,该反应的化学方程式为 .
(2)为探究上述酸碱反应后,硫酸是否过量.设计了如下两种方法:
方法①:取少量反应的溶液,用pH试纸检验,测得pH<7,表明硫酸过量.
方法②:取少量反应的溶液,向其中滴加适量的BaCl2溶液,可观察到有白色沉淀产生,表明硫酸过量.
上述两种方法中,你认为正确的是方法 (选填“①”或“②”).请用文字说明另一种方法不合理的原因 .