化学兴趣小组同学发现实验台上按如图所示顺序摆放着6瓶不同的无色溶液(如图所示:A、B、C、D、E、F代表对应的溶液).其中E溶液的试剂瓶标签破损.为此,他们做了如下探究:
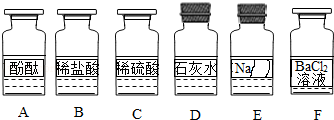
【提出问题】E溶液的成分是什么?
【初步判断】根据受损标签及实验室药品分类摆放原则,E溶液不可能是(填序号).①酸;②碱;③盐.
【提出猜想】猜想Ⅰ:
溶液;猜想Ⅱ:
溶液;猜想Ⅲ:
溶液;猜想Ⅳ:溶液(任写一种).
【设计并实验】兴趣小组的同学为验证"猜想Ⅱ"是否正确,设计并完成如下表所示实验.
| 实验方案 |
实验一 |
实验二 |
实验三 |
| 实验操作 |
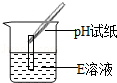 |
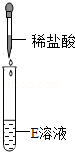 |
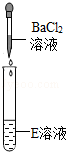 |
| 实验现象 |
试纸变色,对照比色卡,pH>7 |
有无色无味气体产生 |
|
| 实验结论 |
猜想Ⅱ正确 |
【分析与推理】
①完成"实验一"后,李成同学即认为"猜想Ⅰ"正确,张平同学认为"猜想Ⅰ"不一定正确,他的理由是.
②何刚同学认为只需要完成"实验二"即可得出"猜想Ⅱ"正确的结论,你认为该说法(填"合理"或"不合理"),理由是.
③请写出"实验三"中发生反应的化学方程式.
【反思与评价】
经过讨论,同学们认为"实验一"存在明显操作错误,该错误是;观察发现D、E试剂瓶的瓶塞是橡胶塞,使用橡胶塞的原因是.
探究燃烧条件的实验装置如图所示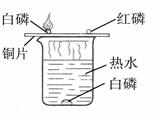
(1)由该实验得出,可燃物燃烧的另外两个条件是:、
(2)实验中使用了铜片,主要是利用铜的什么性质?
某化学兴趣小组用石灰石和盐酸反应制取CO2,并验证CO2的性质。在确认装置气密性良好后进行实验。把制得的气体通入澄清石灰水中,发现石灰水没有变浑浊。对此展开探究:
(1)【提出问题】澄清石灰水为什么没有变浑浊?
(2)【猜想与验证】
①甲同学认为可能石灰水已变质。他取少量澄清石灰水于试管中,向其中吹气,现象是__________,说明澄清石灰水没有变质。写出该反应的化学方程式。
②乙同学认为制得的CO2中可能混有HCl 。他作出此猜想的依据是__________
他用试管取少量紫色石蕊试液,再通入制得的气体,紫色石蕊试液变红,他得出结论是CO2中混有HCl 气体。
③ 丙同学认为乙同学的实验结论是错误的,理由是________________________
请你和他们一起设计实验证明:
| 实验步骤 |
实验现象 |
实验结论 |
| 用试管取少量AgNO3和稀HNO3的混合溶液,通入制得的气体 |
CO2中混有HCl 气体。 化学方程式 |
(3)【反思与评价】丁同学认为既然用盐酸会使制得的CO2不纯,何不用稀H2SO4代替盐酸。请问丁同学的想法对吗?_____,理由是__________________________
小亮对铁丝在氧气里燃烧时出现的红热球状物产生了兴趣,随后他进行了以下探究活动。
【问题1】铁燃烧后剩下来的球状物质中还有没有铁呢?
【实验探究】将剩下来的球状物质碾碎,加入溶液,观察到的现象是,说明铁燃烧时溅落下来的黑色物质中还含有铁。
【问题2】铁燃烧的产物为什么不是Fe2O3呢?
【查阅资料】
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
(3)Fe2O3高温时分解成Fe3O4
【理论探讨】实验测定铁在氧气里燃烧的产物是Fe3O4,结合表中数据,可推知铁在氧气里燃烧时产生的高温应在℃之间,在此温度范围内已分解。
【拓展延伸】
(1)实验中为了防止集气瓶炸裂,必须;
(2)有些食品包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色,就说明包装盒破损进气,这样售货员就能及时发现并处理。
(8分)在学习盐的性质以后,某校化学兴趣小组的同学开展了测定Na2CO3和NaCl
的固体混合物中Na2CO3质量分数的探究实验。他们设计了如下方案:
【方案一】气体分析法。
(1)如下图1所示(铁夹夹持的仪器是注射器),把一定量的混合物与足量稀硫酸反
应后,测定产生CO2的体积,根据CO2的密度计算质量。实验前,向后拉注射器活塞,松开后,如果,则装置不漏气。
(2)有同学提出以图2代替图1中的收集装置,则所测CO2气体的体积(填“偏
大”、“偏小”或“不变”),原因是,你的改进方案是。
(3)也有人用图3装置进行测定,根据盛碱石灰的干燥管质量的增重确定CO2的质量(碱石灰的成分是CaO和NaOH的混合物)。图3实验装置存在明显缺陷,缺陷之一是 __________。
【方案二】沉淀分析法(如图4所示)。则:
(1)试剂A可以是溶液(写一种),加入过量A是为了。
(2)把沉淀洗涤的目的是。
(12分)某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液是:
猜想一:氯化钠溶液;
猜想二:氢氧化钠溶液;
猜想三:碳酸钠溶液。
【实验推断】
(1)小丽取样滴加无色酚酞试液,溶液呈红色,得出结论:该溶液不可能是溶液,理由是 ;
(2)小刚另取样滴加稀盐酸有产生,反应的化学方程式为 ,小刚得出结论:该溶液是碳酸钠溶液。
(3)小青认为小刚的结论不完全正确,理由是。
小组同学讨论后一致认为还需要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有产生,设计这一步骤的目的是;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液是。
【探究启示】实验取完药品后应 。