(本题共8分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以制取乙酸乙酯。回答下列问题:
(1)浓硫酸的作用是: 。
(2) 若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(3) 饱和碳酸钠溶液的主要作用是 。
(4)写出制取乙酸乙酯的化学反应方程式 。
(5) 生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度相等
⑥反应不再继续进行
(7 分)某消毒液的主要成分为 NaClO(混有少量NaCl),请用相应的化学用语来解释下列事实。
(1)该消毒液可用NaOH 溶液吸收Cl2 制备,化学方程式为 。
(2)该消毒液的pH 约为12,离子方程式为 。
(3)向FeSO4溶液中滴入少量该溶液,溶液颜色变成棕黄色,反应的离子方程式为 。
(4)该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险。每产生1 mol Cl2(标准状况下),转移电子个数约为 。
(8分)有A、B、C三种无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
(1)试判断它们各是什么物质:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式:
A__________________________________
C:________________________________。
已知乳酸的结构简式为 。试回答:
。试回答:
①乳酸分子中含有________和_________两种官能团(写名称);
②乳酸与足量金属钠反应的化学方程式为___________________;
(6分)根据结构对有机物进行分类,有助于对其性质的掌握。
①下列有机物属于芳香烃的是 (填字母),
a. b.
b.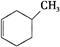 c.
c.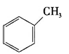
②下列有机物属于羧酸类的是 (填字母)。
a.CH3CHOb.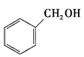 c.
c.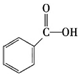
③下列有机物属于糖类的是 (填字母)。
a.油脂b.纤维素c.蛋白质
已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
(1)A分子中官能团的名称是 ,反应①的化学反应类型是 反应。
(2)反应④的化学方程式是 。
(3)某同学用如图所示的实验装置制取少量乙酸乙酯。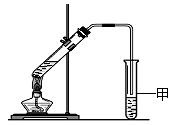
实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是 。
②若分离出试管甲中该油状液体需要用到的仪器是________(填序号)。
a.漏斗 b.分液漏斗 c.长颈漏斗
③实验结束后,若振荡试管甲,会有无色气泡生成,其主要原因是 (结合化学方程式回答)。