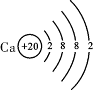
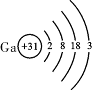
下表是元素周期表中部分元素的原子结构示意图,请回答有关问题:
| 周期 族 |
ⅠA (读作“第一主族”) |
ⅡA (读作“第二主族”) |
ⅢA (读作“第三主族”) |
| 第2周期 |
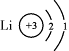 |
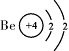 |
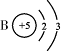 |
| 第3周期 |
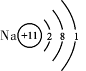 |
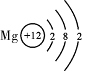 |
X |
| 第4周期 |
Y |
 |
 |
(1)1869年, 发现了元素周期律并编制了元素周期表(选填“拉瓦锡”或“门捷列夫”)。
(2)钠离子的核外电子数为 。
(3)经分析发现,元素的周期序数与原子的电子层数、元素的主族序数与原子的最外层电子数有着密切的关系。请推断X原子的最外层电子数为 ,Y原子的电子层数为 。
(4)若镓(Ga)元素与氯元素只能组成一种属于盐的化合物,该化合物的化学式为 。
生活离不开化学。现有①氮气,②活性炭,③甲烷,④盐酸,⑤石油,选择适当的物质填空(写序号):能吸附异味的物质是 ;食品包装袋中常用来防腐的是 ;可用于金属表面除锈的是 ;属于化石燃料的是 ;天然气的主要成分是 。
用化学用语表示:2个硅原子 ,3个氢氧根离子 。
水是生命之源.
(1)在电解水实验中,与直流电源正极相连的玻璃管中产生的气体是 .
(2)配制50g质量分数为6%的NaCl溶液,其操作步骤为: 、称量、量取、溶解、装瓶贴标签.
(3)下列情况会导致(2)中所配制的溶液中溶质的质量分数偏大的是 (填字母序号).
A.所用的NaCl不干燥
B.用量筒量取水时,俯视读数
C.配好的溶液装瓶后,烧杯内有溶液残留.
钢铁是使用最多的金属材料.
(1)铁制品锈蚀的过程,实际上是铁跟空气中的 发生化学反应的过程;可用稀硫酸除去其表面的铁锈,反应的化学方程式为 .
(2)锰(Mn)钢属于铁合金,可用于制造钢轨.已知锰的金属活动性介于镁与锌之间,如果用实验比较铁和锰的金属活动性强弱,下列所给试剂组能够达到目的是 (填字母序号).
A.Fe、Mn、40%硫酸溶液 B.Fe、Mn、MgSO4溶液
C.Fe、Mn、ZnSO4溶液 D.Cu、FeSO4溶液、MnSO4溶液.
如图中A、B分别是某微粒的结构示意图,回答下列问题:
(1)若A是某阴离子的结构示意图,则x可能是下列中的 (填字母序号)
a.8 b.10 c.11 d.12
(2)若B表示某原子的结构示意图,则y= 。
(3)若A中x=12,则A、B所表示的元素形成化合物的名称为 。
