请你参与下列探究:
【问题情景】在课外活动中,小斌按照课本实验(见图1)探究分子的运动时,闻到了刺激性的氨味,于是,小斌在老师的指导下,设计了如图2的实验装置,进行同样的实验,结果不再有刺激性的氨味,并且快速出现实验现象,得到了和课本实验同样的结论。
【实验探究与结论】小斌用图2装置进行实验。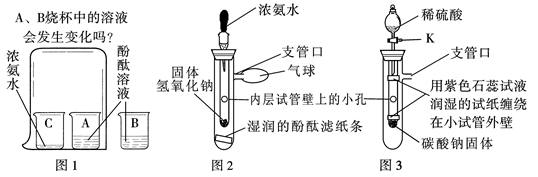
(1)滴入少量浓氨水后,湿润的酚酞滤纸条发生的变化是 。从分子运动的角度分析,此现象可说明的结论是 ;从浓氨水化学性质的角度分析,此现象可说明的结论是 。
(2)用初中的化学知识分析,固体氢氧化钠的作用是 。
(3)和课本实验比较,小斌改进后的装置的优点是 。(写一点)
【思维拓展】小媚受小斌实验的启发,将图2装置进一步改装成图3装置,用于验证二氧化碳的性质。
(1)打开活塞K滴入稀硫酸后,两条用紫色石蕊试液润湿的试纸发生的相同变化是 ,不同变化是 ,小媚从课本实验中知道,二氧化碳和水本身都不能使石蕊变色,因而她认为以上两个变化验证的二氧化碳的性质依序是 、 。
(2)小柔认为小媚的装置还可以同时验证:①二氧化碳能使澄清石灰水变浑浊 ;②二氧化碳不能燃烧,也不支持燃烧。小柔为完成自己的两个验证实验,对小媚的实验进行的简单改进是: 、 。
下图甲~丁是实验室制取氧气的装置图。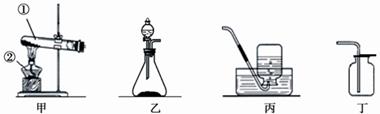
(1)写出仪器的名称:①、②。
(2)甲、乙装置都可用于实验室制氧气,用乙装置制氧气的优点是(填字母)。
A.节约能源 B.可较快获得氧气
C.可随时添加药品 D.操作简单、安全
(3)丙、丁装置都可用于实验室收集氧气。下面是对两种收集方法的相关比较(使用容积相同的集气瓶收集氧气)。
| 比较的方面 |
排水法 |
向上排气法 |
结论 |
| 方法可行性 |
O2难溶于水,且不与水反应。 |
O2的密度比空气_____(填“大”或“小”),且不与空气中的物质发生反应。 |
两种方法均可行。 |
| 收集O2的纯度 |
分别用排水法和向上排空气法收集两瓶氧气(A和B), 放入两支相同的蜡烛,可观察到B瓶内的蜡烛熄灭较早。 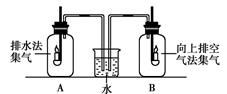 |
结论______。 |
“过氧化钠(Na2O2)”是一种淡黄色固体,能与水或二氧化碳反应放出氧气。实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分及其质量。
【提出问题】变质的过氧化钠粉末中有哪些成分,它们的质量是多少?
【查阅资料】
①2Na2O2+2H2O═4NaOH+O2↑ 2Na2O2+2CO2═2Na2CO3+O2
②碳酸钠溶液显碱性,氯化钙溶液显中性。
③Na2CO3+ CaCl2═CaCO3↓+2 NaCl
【猜想与假设】
(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是________________________的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
……
【设计实施方案】
| 实验步骤 |
实验现象 |
| ①取3.00g变质粉末于一支大试管内,加入适量的水,共收集到0.32g气体,然后用带火星木条检验生成的气体。 |
固体完全溶解,______________________ |
| ②继续向上述试管中加入足量的石灰水,充分反应。 |
__________________________________ |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体1.00g。 |
【解释与结论】同学们经过认真分析,得出了以下结论。
粉末中含有的成分及质量
| Na2O2 |
NaOH |
Na2CO3 |
|
| 成分(填“有”或“没有”) |
|||
| 质量(g) |
【反思与评价】
(1)实验室在保存过氧化钠时应注意_______________。
(2)有同学提出把第②步实验中足量的石灰水改为足量氯化钙溶液,至沉淀不再生成时过滤,向滤液中滴加无色酚酞试液,若液体变红,则证明原粉末中有NaOH。你认为该方案是否合理并说明理由____________________________。
用下面的装置将一定量的CO2和CO的混合气体进行分离和干燥。图中的a、b、c、d均为活塞,可以控制气体的通过和液体的加入,实验前活塞均已关闭。请选择适宜的试剂完成上述实验。
供选用的试剂有:①稀硫酸②浓硫酸③氢氧化钠溶液④澄清的石灰水(试剂均足量)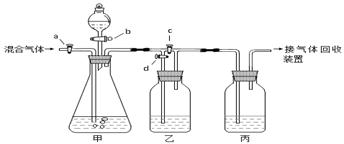
实验分以下两步进行:
(1)关闭b、c,打开a、d,则甲中发生反应的化学方程式为_______________,丙中试剂为(填数字序号)。若乙装置中的现象是 ______,说明甲装置中反应是充分的。 此步实验后收集到的气体是。
(2)在甲装置的分液漏斗中加入试剂①,然后_________________________,即可收集到另一种气体。
化学是一门以实验为基础的自然科学。依据实验目的设计切实可行的的实验方案是科学探究中的重要环节。
甲乙丙
(1)用甲装置测定水的组成。a试管中气体能燃烧,该气体是___,正极与负极产生气体的质量比为_____。甲装置中发生反应的化学方程式为__________________。
(2)小红同学用乙装置进行探究实验,观察现象得出结论。
①蜡烛中含有氢元素,她依据的现象是 ______________________ 。
②一段时间后,小红观察到蜡烛熄灭,由此得出可燃物燃烧必须具备的条件是。
(3)用丙装置测定空气中氧气的含量。下列有关该实验的说法中,正确的是(填
字母序号)。
| A.实验时红磷一定要足量 | B.点燃红磷前先用弹簧夹夹紧乳胶管 |
| C.红磷熄灭后立刻打开弹簧夹 | D.最终进入瓶中水的体积约为消耗氧气的体积 |
化学课上第一小组的同学做了碳酸钠溶液和A溶液反应的实验,有沉淀产生,同学们对浑浊液过滤,得到澄清滤液。第二小组甲、乙、丙三位同学对该实验进行了一系列的探究。
探究一 A溶液中的溶质是什么?
【相关资料】Ⅰ.CaCl2 + Na2CO3 CaCO3↓+ 2NaClⅡ.CaCl2溶液呈中性
(1)【提出假设】第二小组同学认为A溶液的溶质有两种可能:
①是___,②是CaCl2。
(2)【设计实验】第二小组同学设计了如下方案并进行实验:
| 实验操作 |
实验现象 |
实验结论 |
| 取少量A溶液于试管中,向其中滴加溶液 |
__ |
假设①正确。 碳酸钠与其反应的化学方程式为__。 |
第一小组同学肯定了他们的实验结论。
探究二过滤后澄清滤液中会有哪些溶质?
【提出假设】
(3)甲的合理猜想;丙的合理猜想。
(4)【实验验证】乙同学针对自己的猜想进行了如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中,滴入几滴稀盐酸 |
没有气体产生 |
猜想不成立 |
你认为乙同学的实验结论是否正确?,其理由是。
(5)【继续探究】请你设计实验方案确定滤液中溶质的组成。
| 实验操作 |
实验现象 |
实验结论 |