25℃,NaOH和Na2CO3两溶液的pH均为11.
(1)两溶液中,由水电离出得c(H2O)分别是①NaOH中 ,②Na2CO3中 ,③在1L水中加入上述 会使水的电离程度减小。
(2)各取10mL上述两种溶液,分别加水冲稀到100mL,pH变化较大的是 ,(填化学式)溶液。
(3)现有0.1mol/L的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是 ,你认为该溶液pH的范围一定介于 之间。
化合物M是某种解热镇痛药,以A为原料的工业合成路线如下图所示:
|
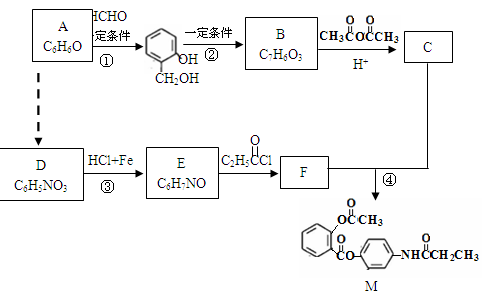
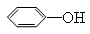 +
+
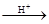
 +CH3COOH
+CH3COOH

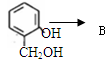 不能一步完成,请解释可能的原因。
不能一步完成,请解释可能的原因。
PHBV( )是一种可降解的高分子材料。此类产品可用于食品包装、化妆品、医药、卫生及农业等行业。它可由互为同系物的M、N(均为不饱和烃)等原料经下列路线合成:
)是一种可降解的高分子材料。此类产品可用于食品包装、化妆品、医药、卫生及农业等行业。它可由互为同系物的M、N(均为不饱和烃)等原料经下列路线合成:

完成下列填空:
(1)写出N的结构简式,C中官能团的名称。
(2)写出反应类型:M→A。B的同分异构体中能被新制氢氧化铜悬浊液氧化的有种。
(3)由E和D合成PHBV的化学方程式是。
(4)由乙醇制取乙酸的方法与过程可表述如下:
C2H5OH CH3CHO
CH3CHO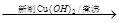 CH3COOH
CH3COOH
请用上述表述方法表示由C合成D的方法与过程:
。
研究NO2、SO2、CO等大气污染物的处理具有重要意义。NO2可用下列反应来处理:
6 NO2(g)+8NH3(g) 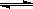 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
完成下列填空:
(1)反应的平衡常数大,处理NO2的效率高。增大该反应平衡常数的措施有。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2) = 7v(N2)
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若平衡时NO2和N2的浓度之比为m/n,保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比 m/n(填“>”、“=”或“<”)。
(4)某温度下,在一个容积为2升的反应容器内,上述反应2分钟后达到平衡,测得刚好有3mol电子发生转移,则在2分钟内NH3的平均反应速率为:
v(NH3) = 。
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,反应如下:
3SiCl4 +2N2 +6H2 Si3N4 +12HCl
Si3N4 +12HCl
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于 晶体。有关氮化硅的上述反应中,原子最外层只有一个未成对电子的元素是(填写元素符号);属于非极性分子的化合物的电子式是。
(2)比较Si和Cl两种元素非金属性强弱的方法是。
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较两种元素的原子达到稳定结构获得电子的多少
d.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为(简述理由),写出Si与强碱溶液反应的离子反应方程式:。
G是一种工业增塑剂,其合成的流程如下:
已知:(1)A侧链上有两种不同环境下的氢原子;(2)B是芳香烃
(1)A中含氧官能团的名称,F的分子式,
C→D的反应条件,B的结构简式。
(2)A1是与A含有相同官能团的同分异构体,同条件下也能制得B,写出A1生成B的化学方程式。
(3)写出D→E的化学方程式。
(4)F物质的消去产物H是一种药物中间体,关于H的下列叙述正确的是。
a.能发生取代、消去、氧化、加聚反应
b.将H加入溴水中,振荡后得到无色溶液
c.等物质的量H与F反应后,生成物可能的分子式C18H16O4
d.1mol H在一定条件下与H2反应,最多消耗H2 4mol
(5)E有多种同分异构体,符合下列条件的芳香族同分异构体共有种。
①既能与稀硫酸又能与NaOH溶液反应②能发生银镜反应
③分子中只有一个甲基