已知20℃时NaCl的溶解度为36 g。某氯碱厂使用的设备是阳离子交换膜电解槽,若一次向电解槽中加入一定量20℃时饱和NaCl溶液,当90%的NaCl电解时,阴极收集到11. 2 m3气体(已折算成标准状况)。请回答下列问题:
(1)该反应的离子方程式为 。
(2)取阳极区溶液作系列实验,下列结论中错误的是 。(填字母)
| A.滴加酚酞试剂,先变红后褪色 | B.滴加硝酸银溶液,有白色沉淀产生 |
| C.滴加小苏打溶液,有气泡产生 | D.做焰色反应实验呈黄色 |
(3)计算原饱和NaCl溶液的质量 kg(精确到0.1kg)。
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少 m3?
(甲烷的电极反应式:CH4+10OH--8e— = CO32—+7H2O
假设该燃料电池的能量利用率为90%。折算成标准状况。精确至0.1 m3)
斑螯素能抑制肝癌的发展,去掉斑螯素中的两个甲基制得的化合物——去甲基斑螯素仍具有相应的疗效,其合成路线如下:
已知:① 2HCHO+NaOH→ CH3OH+HCOONa
②  (Diels-Alder 反应)
(Diels-Alder 反应)
③当每个1,3-丁二烯分子与一分子氯气发生加成反应时,有两种产物: CH2ClCH=CHCH2Cl;CH2ClCHClCH=CH2。
请回答下列问题:
(1)物质A中含有的含氧官能团名称分别为;第①步反应中还生成另一产物,此产物的结构简式为。
(2)写出H的结构简式;第⑤步反应的反应类型是。
(3)去甲基斑螯素与X互为同分异构体。X能与FeCl3溶液发生显色反应,能与Na2CO3溶液反应生成气体,且其核磁共振氢谱有4个吸收峰。写出满足上述条件的X的一种结构简式。
(4)结合题中有关信息,写出由 制备丁烯二酸酐
制备丁烯二酸酐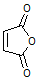 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
。
(12分) 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: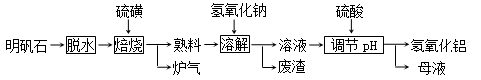
回答下列问题:
(1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S  2Al 2O3+9SO2,其中氧化剂为。
2Al 2O3+9SO2,其中氧化剂为。
(2)“溶解”时反应的离子方程式为。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是
。
(4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882 g/L 的H2SO4 ,配制1L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8g/cm3)
mL
(5)“废渣”、“母液”中可回收的物质分别是。
下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH2K2CO3+6H2O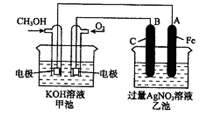
(1)请回答图中甲、乙两池的名称。甲电池是装置,乙池是装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是,B(石墨)电极的名称是。
(3)写出电极反应式:
通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(4)乙池中反应的化学方程式为。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu====2Fe2++Cu2+,可以写成:氧化反应 Cu—2e—====Cu2+;还原反应 2Fe3++2e—====2Fe2+(或Fe3++e—====Fe2+)。
(1)根据以上信息将反应3NO2+H2O===2H++2NO3—+NO拆分成两个“半反应式”:
氧化反应式;还原反应式。
(2)已知某一反应的“半反应式”为CH4+10OH——8e—====CO32—+7H2O;O2+2H2O+4e—
====4OH—,则总反应式为。
下图所示水槽中试管内有一枚铁钉,放置数天后观察: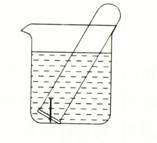
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。
(2)若试管内液面上升,则原溶液呈性,发生腐蚀,正极反应式为。
(3)若试管内液面下降,则原溶液呈性,发生腐蚀,正极反应式为。