已知:
I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
(1)A为饱和一元羧酸,8.8g A与足量NaHCO3溶液反应生成2.24L CO2(标准状况),A的分子式为___________________。
(2)写出符合A分子式的所有甲酸酯的结构简式: ______________________________。
(3)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B→C的反应方程式:
__________________________________________________________。
(4)C+E→F的反应类型为________________________。
(5)写出A和F的结构简式:A______________________; F__________________________。
(6)D的苯环上有两种氢,它所含官能团的名称为___________________;写出a、b所代表的试剂:a ______________; b___________。
Ⅱ. 按如下路线,由C可合成高聚物H:
(7)C G的反应类型为_____________________.
G的反应类型为_____________________.
(8)写出G H的反应方程式:_______________________。
H的反应方程式:_______________________。
下表中五个小实验,每个小实验有一项未填写,试按要求填空:
下表是元素周期表中短周期部分,表中所列字母分别代表一种元素,试回答有关问题。
(1)只由A、D、F三种元素组成的可为人体提供能量的营养物质是(填其中一种物质的名称)
(2)A和D可形成一种最简单化合物,它的分子构型为:。这种化合物含
键。(填“极性”或“非极性”)
(3)由上表元素中的两个原子形成的阴离子的电子式为。
(4)NH3·H2O的电离方程式为:,据此电离方程式推断NH3溶于水后的合理结构是:(填序号)。
(5)下图是A2与F2发生反应生成A2F的途径和三个状态的能量(E)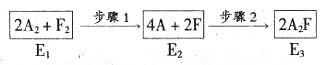
则:①步骤l是(填“吸热”或“放热”,下同)过程,步骤2是过程。
②比较E1、E2、E3的大小。(由大到小顺序排列)
自20世纪90年代以来,稠环化合物的研究开发工作十分迅速,这一类物质在高科技领域有着十分广泛的应用前景。下面是苯和一系列稠环芳香烃的结构简式: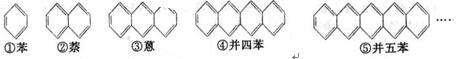
试解答下列问题:
(1)写出化合物②⑤的分子式:
①C6H6②_____________ ③____________ ④____________ ⑤
(2)这组化合物分子式的通式是:____________
(3)某课外兴趣小组,做了系列实验,他们将该系列的前5种芳香烃逐一加到浓的酸性高锰酸钾溶液中加热。结果发现,只有苯无明显变化,其余4种物质都能使酸性高锰钾溶
液褪色。经分析知后4种稠环芳烃的氧化产物是: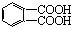 、
、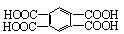
或者两者都有。由此你能得出的结论是:__________________,
(4)甲、乙、丙三同学同做酸性高锰酸钾溶液氧化并五苯的实验。甲将氧化后的混合液酸化分离得到一种无色晶体X,称取0.2540g X,用热水配成100mL溶液中和滴定,取出25.00mL,用0.1000mol·L-1 NaOH溶液中和滴定,滴到10.00mL时达到终点;丙用酸性高锰酸钾氧化并五苯,将氧化后的混合液酸化分离得到无色晶体Y,中和测定知Y的中和能力只有X的中和能力的一半;乙用酸性高锰钾溶液氧化并五苯,将氧化后的混合液酸化分离得无色晶体,经分析其中包含了甲与丙得的两种成份,通过计算推理确定X的结构简式。
(5)在Y的同分异构体中与Y同属芳香族化合物既可看作羧酸类,又可看作酯类的同分异构体的结构简式有:______________________________________________________ ,
在Y的同分异构体中既不属于羧酸类,又不属于酯类,但可看作常见芳香烃的衍生物的同分异构体的结构简式有(写一种)
在图2—10甲、乙、丙、丁四个装置中,A、B为未充气气球,C为玻璃导管,D为胶头滴管。实验时把胶头滴管里的溶液(足量)加入锥形瓶中,并轻轻震荡。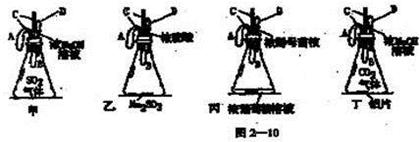
(1)(8分)实验过程中可观察到气球的变化:
甲__________________________;乙_________________________;
丙__________________________;丁_________________________。
(2)(8分)用化学方程式表示所发生的化学反应
甲______________________________,乙_________________________,
丙_____________________________ ,丁__________________________.
(3)(6分)反应前后整个装置的质量变化(填“增大”“减小”或“不变”等)
甲,乙,丙,丁。
据2000年4月出版的《参考消息》报道:美国硅谷已成功开发出分子计算机,其中主要器件为分子开关和分子导线。美国Gokel教授研制了氧化还原型电控分子开关——蒽醌套索醚电控开关。它是通过电化学还原使冠醚“胳膊”阴离子化,从而加强对流动阳离子的束缚力,达到“关”的作用;再借助氧化反应使其恢复到原来的“开启”状态,使阳离子顺利流动: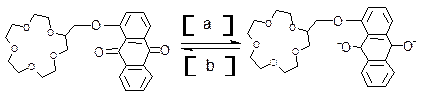
A B
(1)在括号中填写反应类型(填氧化反应.还原反应):a ▲ 反应,b ▲ 反应。
(2)若分子计算机中分子开关处于A状态,则计算机处于▲ 状态,若分子计算机中分子开关处于B状态,则计算机处于▲ 状态(填“开启”或“关闭”)。