某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示:
(1)该温度下水的离子积为 (填具体数值);该温度 常温(填“高于”、“低于”或“等于”)。
(2)该温度下0.01 mol/L NaOH溶液的pH为 。
(3)除了用pH外,科学家还建议用酸度(AG)来表示溶液的酸碱性: 。则该温度下,0.01mol/L盐酸的酸度AG= 。
。则该温度下,0.01mol/L盐酸的酸度AG= 。
(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)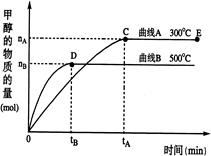
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= __________ ,升高温度,K值__________(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= __________
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 __________
a. 氢气的浓度减少 b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加 d. 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:____________________(用化学方程式表示)
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与__________有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是__________(填字母,下同)。
a.容器中的压强不变b.1 mol H—H键断裂的同时断裂2 molH—O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应  CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为__________。
②该反应的逆反应为 __________(填“吸”或“放”)热反应
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g)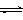 CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。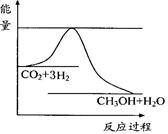
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
25℃时,50mL0.1mol/L醋酸中存在下述平衡:_______________________。若分别作如下改变,对上述平衡有何影响?
⑴加入少量冰醋酸,平衡将__________,溶液中c(H+)将__________(增大、减小、不变);
⑵加入一定量蒸馏水,平衡将__________,溶液中c(H+)将__________(增大、减小、不变)
⑶加入少量0.1mol/L盐酸,平衡将__________,溶液中c(H+)将__________(增大、减小、不变)
⑷加入20mL0.10mol/LNaCl,平衡将__________,溶液中c(H+)将__________(增大、减小、不变)
氢化阿托醛 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下: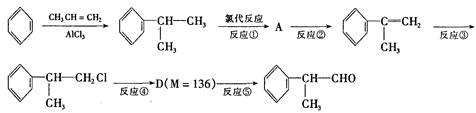
(1)在合成路线上②③的反应类型分别为② ③ 。
(2)反应④发生的条件是。
今有相对分子质量为M的有机物,燃烧后只生成二氧化碳和水。
①若有机物是M=72的烃,请写出所有可能的结构简式:_________;_________;_________。
②若M=58,且1mol该有机物与足量的银氨溶液作用,可析出4molAg, 则其结构简式为:_________________
则其结构简式为:_________________
③若A是分子 式为C12H16的烃,B是含4个氧原子的烃的含氧衍生物,A、B相对分子质量相等,则B的分子式可能为:______________________。
式为C12H16的烃,B是含4个氧原子的烃的含氧衍生物,A、B相对分子质量相等,则B的分子式可能为:______________________。