利用海水资源进行化工生产的部分工艺流程如图: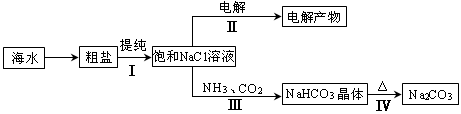
(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 。
a.Na2CO3、NaOH、BaCl2、过滤、盐酸 b.NaOH、BaCl2、Na2CO3、过滤、盐酸
c.NaOH、Na2CO3、BaCl2、过滤、盐酸 d.BaCl2、Na2CO3、NaOH、过滤、盐酸
(2)流程II中,电解饱和NaCl溶液的离子方程式为 。通电开始后,阳极区产生的气体是 ,阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
(3)流程III中,通过反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,化学反应方程式是 。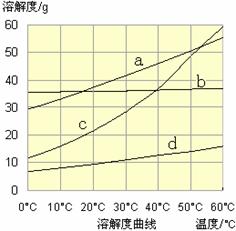
(4)流程IV中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3•10H2O,Na2CO3•10H2O脱水得到无水碳酸钠,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2=" +473.63" kJ·mol-1
把该过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。
(8分)(1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为:
②当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3·H2O)_______n(HCl),溶液中c( NH4+)_______c(Cl-)。(填“>”或“<”或“=” )
(2)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①___和__两种粒子的物质的量之和等于0.1mol。
②___和___两种粒子的物质的量之和比OH―多0.05mol。
(12分)(1)已知在一定温度下:C(s)+CO2(g) 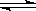 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 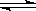 CO(g)+H2(g)平衡常数K1;
CO(g)+H2(g)平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是:。
(2)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阳极的电极反应式是 。
。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,装入锥形瓶中,用一定浓度的标准I2溶液进行滴定,所用指示剂为,滴定终点时的颜色变化为。
(4)用标准NaOH溶液滴定盐酸时,滴定前俯视读数,滴定后仰视读数,会造成测定结果。(填“偏大”、“偏小”或“无影响”)
(5)如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是。
把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为。
(6)怎样除去锅炉中难溶的硫酸钙沉淀?
(7)某温度下,水的离子积常数Kw = 1.0×10-12mol2·L-2。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,当混合溶液的pH=7时,H2SO4溶液与NaOH溶液的体积比为。
某物质可能含有炭粉、碳酸钙、氧化铜、氧化铁中的一种或几种,现进行如下实验:
(1)取样品,加热至高温,产生一种能使澄清石灰水变浑浊的无色气体。
(2)往冷却后的固体残渣中加入足量的稀盐酸,固体残渣全部溶解,同时产生一种可燃性气体。根据以上实验推断:该固体一定含有_____________,一定不含有______________,可能含有_____________(以上各空填写化学式)
(1)新制氯水中含有的溶质有_____________,放久了的氯水会变为________________,写出变化过程中反应的化学方程式:①_____________________;②________________________。
(2)将新制的氯水分成三份:
①向其中第一份中滴入 溶液,离子方程式是;
溶液,离子方程式是;
②向第二份中滴入 溶液,离子方程式是;
溶液,离子方程式是;
③向第三份中滴入紫色石蕊试液,现象是先___________后_____________。
(3)工业上制取漂白粉的化学方程式是。漂白粉溶于水跟水中的 反应,生成具有漂白性的物质,其化学方程式是。
反应,生成具有漂白性的物质,其化学方程式是。
处于下列状态的物质中:①硫酸钡晶体②干冰③HCl气体 ④铜⑤蔗糖⑥熔融的硝酸钾⑧NaCl溶液 ⑨醋酸
(1)能导电的是(填字母,下同);
(2)属于电解质的是;强电解质;弱电解质;
(3)属于非电解质的是。