利用太阳能分解水生成的氢气,在催化剂作用下氢气与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是 kJ。
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为 。
(3) 在容积为2 L的密闭容器中,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):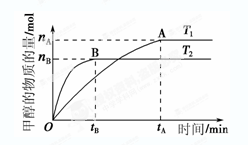
①可逆反应的平衡常数表达式K=
②下列说法正确的是
| A.温度为T1时,从反应开始到平衡,生成甲醇 的平均速率为v(CH3OH)=  mol·L-1·min-1 mol·L-1·min-1 |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.该反应为放热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时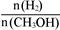 增大 增大 |
③在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为 ;
(4) 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为
2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ;
负极的反应式为 。[来
现有X、Y、Z、M四种元素均为短周期元素。有关信息如下表:
| 原子或分子结构、单质或化合物相关信息 |
|
| X |
含X元素的物质焰颜色反应为黄色 |
| Y |
单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得Y的单质 |
| Z |
Z元素原子易失去2个电子形成8电子结构的离子 |
| M |
M元素原子的最外层电子数是K层电子数的3倍,M与X处于同一周期 |
(1)X元素在周期表的位置是;
(2)1个Y单质分子中含对个共用电子对;
(3)Z能在CO2气体中燃烧,其化学反应方程式为。
(4)化合物X2M溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质X2M2,其溶液显黄色.则X2M2的电子式为,用化学方程式表示X2M溶液在空气中的变质过程.
香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得: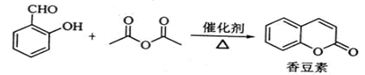
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)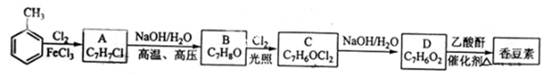
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的化学名称为__________;
(2)香豆素的分子式为_______;由甲苯生成A的反应类型为___________;
(3)B的同分异构体中含有苯环的还有_____种,其中在核磁共振氢谱中只出现四组峰的有_____种;
(4)由B生成C的化学反应方程式为___________;
(5)D的同分异构体中含有苯环的还有______种,其中:既能发生银境反应,又能发生水解反应的是________(写结构简式)。
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。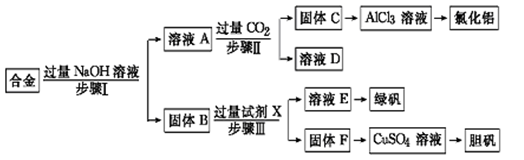
请回答:
(1)写出步骤Ⅰ反应的离子方程式:。
(2)试剂X是。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是。
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是。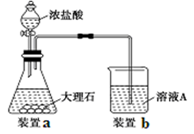
(4)用固体F制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式,请选出你认为的最佳途径并说明选择的理由。
(9分) 在下列物质转化中,已知A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系: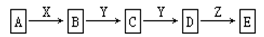
说明:当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。(已知H2CO3、H2S、H2SO3、H2SiO3皆为二元弱酸)
请回答下列问题:
(1)A是,Y是,Z是(填化学式,下同)。
(2)当X是强酸时,E是,写出B生成C的化学方程式: _____ 。
(3)当X是强碱时,E是,写出D生成E的离子方程式: _____。
(9分) 向浓度相等、体积均为50 mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100 mL。
(1)在KOH溶液中通入一定量的SO2气体后,溶液中溶质的组成可能是:
①; ②;
③; ④。
(2)在稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生SO2的体积(标准状况)与所加盐酸的体积关系如下图所示。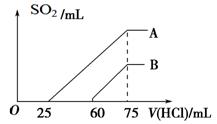
①A曲线表明,原溶液通入SO2气体后,所得溶质与盐酸反应产生SO2的最大体积是____mL(标准状况)。
②B曲线表明,原溶液通入SO2气体后,所得溶液中溶质的化学式为_________________。
③原KOH溶液的物质的量浓度为________ ____。