海水资源的利用具有非常广阔的前景。
(1)海水的潮起潮落蕴含巨大的能量,潮汐能和 (写一种)属于新能源。海底矿产“可燃冰”的开发产品与天然气的主要成份相同, 是 (写化学式)
(2)海水淡化是解决淡水资源危机的有效途径之一,下列水的净化方法中,能使海水淡化的是 (填序号,下同)。
①过滤 ②吸附 ③蒸馏 ④消毒
(3)从海水中提炼出来的重水(D2O)可作原子能反应堆的中子减速剂和传热介质,重水中的D原子核内有一个质子、一个中子,下列说法正确的是 。
①D原子与氢原子属于同种元素 ②重水的相对分子质量为18
③D原子核外有一个电子 ④D原子的相对原子质量为2
(4)海水中含有多种盐,如氯化钠、氯化镁等。海水晒盐大致经历图1所示的过程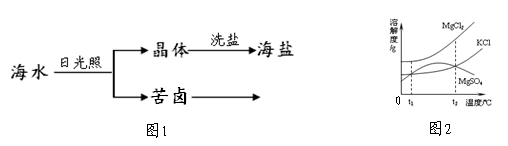
①图2是苦卤中有关物质的溶解度曲线,已知t1℃时,氯化镁和氯化钾的溶解度分别为M、N,则它们溶解度大小的关系为_____________:将苦卤加热到t2℃以上,根据溶解度曲线,首先析出的晶体应是__________。
②在晒盐时,海水中的氯化镁等也有少量结晶析出,所以海盐生产要经历用饱和食盐水洗盐的过程,采用饱和食盐水做洗液的原因是 。
在实验室用高锰酸钾固体制取氧气的研究中,老师为志强同学提供了下列仪器(导管、橡皮塞等已省略),请你帮他完成相关实验内容。
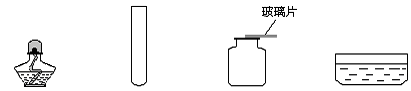
①②③④⑤
(1)志强为了制取一瓶干燥的氧气,他应该选用的仪器有:(填编号),该反应的化学方程式为,此处收集气体的方法为。
(2)向制气装置内加入药品前,他应该进行的操作是,其具体操作步骤是:。
(3)志强同学认为,在不改变发生装置的前提下,他还可以选用(填反应物名称)与二氧化锰来制取氧气,其反应的化学方程式为。
(4)实验室还可以用红砖粉末与一种液体试剂混合制氧气,该反应的化学方程式为。
(5)以下是木炭在氧气中燃烧的实验图:
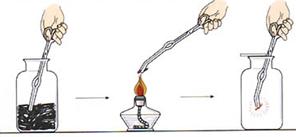
验证燃烧产物的方法:。
阅读下列科普短文,然后回答问题。
臭氧(O3)在通常状况下是淡蓝色、有鱼腥臭味的气体。它不稳定,一旦受热极易转化成氧气,并放出大量的热,臭氧的氧化能力比氧气强得多。若将氧气通过臭氧发生器,在无声放电条件下,从臭氧发生器出来的氧气中含有3%的臭氧。
臭氧在地面附近的大气层中含量极少,在离地面25 km处有一个厚度极薄的臭氧层;臭氧层能吸收太阳辐射中的大量紫外线,使地球上的生物免遭紫外线的伤害,它是一切生命的保护层。超音速飞机排出的废气中的一氧化碳、氮的氧化物等气体、家用电冰箱中使用的制冷剂“氟里昂”等对臭氧层有很大的破坏作用,会使臭氧层形成空洞,从而使更多的紫外线照射到地球表面,导致皮肤癌的发病率大大增加,如不采取措施,后果不堪设想。
(1)将带火星的木条伸入到盛有臭氧的集气瓶中,可以看到的现象。
(2)写出在臭氧发生器中,氧气转变为臭氧的化学方程式。
(3)应采取的方法保护臭氧层。
(4)二氧化硫遇到臭氧微热,即被迅速氧化成三氧化硫,三氧化硫跟水反应能生成硫酸,这是除去废气中二氧化硫的理想方法。写出二氧化硫与臭氧反应的化学方程式。
某公司研制出了一种新颖的“装饰树”,下表为该产品介绍。
| 产品介绍 |
| “装饰树”表面涂了一层光触媒,这种光触媒是一种纳米级二氧化钛,能产生强烈的降解功能,能有效降解空气中的有毒有害气体,如甲醛、一氧化氮、二氧化硫、一氧化碳等。在降解过程中光触媒不挥发,不消耗,具有长效性。 |

(1)根据产品介绍可判断降解反应中二氧化钛是一种(填“反应物”、“生成物”或“催化剂”)。
(2)上图是某科研小组探究两代光触媒降解一氧化氮的实验结果,由此可知:
①第一代光触媒产生强烈的降解作用的条件是;
②第二代光触媒与第一代光触媒相比,优点是(写出一点即可)。
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
| I A |
II A |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
| 3 |
11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息:。
(2)第3周期中相对原子质量最大的金属元素的是。
(3)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是(填标号)。
a.C和Neb.Be和Mgc.Al和Si d.F和Cl
(4)第9号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体和水,该反应的化学方程式为。
镁条在空气中燃烧,不仅生成氧化镁、氮化镁,还有少量镁与二氧化碳反应生成另一种单质和镁的氧化物。
(1)写出镁条在氧气中燃烧的化学方程式:。
(2)已知氮化镁中氮元素的化合价为-3,请你写出氮化镁的化学式:。
(3)写出镁与二氧化碳反应的化学方程式:。