2003年9月,全国展开了声势浩大的围剿“毒鼠强”的行动,已知毒鼠强的结构式如图,有关“毒鼠强”(化学名:甲亚甲基二砜四胺)的下列相关说法正确的是( )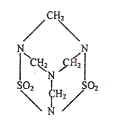
| A.毒鼠强属于有机物 |
| B.毒鼠强属于烃 |
| C.四个氮原子构成正四面体 |
| D.毒鼠强的分子式为C4H3S2O4 |
设NA为阿伏伽德罗常数的数值,则下列说法中正确的是
①2.24L氨气含有NA个电子,②1.4g乙烯与丙烯的混合气体含有NA个碳原子,③精炼铜,若阳极失去2NA个电子,则阴极增重64g,④标准状况下,22.4L空气含有NA个分子,⑤过氧化钠与水反应,若电子转移4NA,则产生的氧气为32 g,⑥将1L 2mol/L 的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA,⑦在1L 0.1mol/L的碳酸钠溶液中,阴离子总数大于0.1NA
| A.②③④⑦ | B.①③④⑦ | C.②③④⑤⑦ | D.②④⑤⑦ |
如图所示是两个甲分子发生反应生成丙分子和乙分子的过程,则下列判断正确的是
| A.该反应为置换反应 | B.一个丙分子内有两对共用电子对 |
| C.乙分子中存在非极性键 | D.乙的摩尔质量=2倍甲的摩尔质量-丙的摩尔质量 |
用氢氧化钠固体配制480mL 0.1mol/LNaOH溶液时,下列有关说法错误的是
| A.用到的玻璃仪器有:玻璃棒、胶头滴管、容量瓶、量筒、烧杯 |
| B.洗净的容量瓶必须干燥后,才能用 |
| C.称量2 g氢氧化钠固体 |
| D.没有等溶液冷却就转移,或定容时俯视,均导致所配溶液浓度偏高 |
下列说法正确的是
| A.纳米材料微粒的直径在1~100nm,因此纳米材料属于胶体 |
| B.溶液呈电中性,胶体带有电荷 |
| C.可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人体健康危害极大 |
| D.FeCl3溶液与Fe(OH)3胶体的本质区别是有无丁达尔效应 |
14g铜金合金与足量的某浓度HNO3反应,将产生的气体用1.12L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为
| A.9.6g | B.6.4g | C.3.2g | D.1.6g |