下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
⑨ |
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。 (2)②⑦⑨的最高价含氧酸的酸性由强到弱的顺序为________________________。
(2)②⑦⑨的最高价含氧酸的酸性由强到弱的顺序为________________________。 (3)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其中两种化合物的电子式: ___、 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其中两种化合物的电子式: ___、 。 (4)元素④的一种氢化物A在一定条件下分解为它的另一种氢化物B,写出A的结构式_______
(4)元素④的一种氢化物A在一定条件下分解为它的另一种氢化物B,写出A的结构式_______ 。
。
(5)由①④⑤⑨四种元素组成的两种化合物之间可以发生反应,写出离子方程式 。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: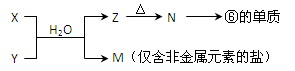
 X溶液与Y溶液反应的离子方程式为_____________________
X溶液与Y溶液反应的离子方程式为_____________________  N→⑥的单质的化学方程式为_____________ _
N→⑥的单质的化学方程式为_____________ _
( 14分)
14分)
电子总数均为14的微粒有X、Y、Z、Q、R、W 6种,按要求填空:
(1)x、Y为两种单质,X的氧化物是制造光导纤维的主要原料,X的 晶体类型为,该氧化物的化学式为;Y为分子晶体,其电子式为。
晶体类型为,该氧化物的化学式为;Y为分子晶体,其电子式为。
(2)Z分子中含有4个原子,其分子的空间构型是。
(3)Q为低价氧化物,请写出有Q生成的置换反应。
(4)R为-2价阴离子,请写出R与钙离子组成的离子化合物与水反应的化学方程式。
(5)W为两种相邻元素构成的-1价阴离子,其钠盐水溶液显碱性的原因是。(用离子方程式表示)。
氯碱工业中,阳极的电极反应式为,阴极产物为;若用石墨电极电解CuSO4溶液,阴阳两极均产生2.24 L气体(标准状况),则析出Cug。
[选修有机化学基础]
某研究人员发现一个破裂的小瓶中渗漏出一未知有机物A,有催泪作用。经分析A的相对分子质量为161,该化合物中除含有C、H元素外还含有一种卤族元素,且分子中只含有一个甲基。化合物A—F的转化关系如下图所示,其中1molC与足量的新制Cu(OH)2溶液反应可生成1molD和1mol Cu2O,B1和B2均为较稳定的化合物且互为同分异构体。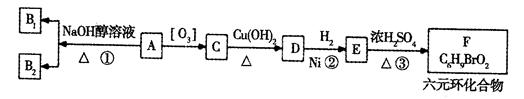
已知(1)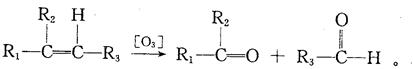
(2)一个碳原子上连有两个碳碳双键的结构(—C="C=" C—)不稳定。
请完成下列问题:
(1)化合物A含有的官能团是____。B1的相对分子质量是。
(2)④、②、③的反应类型分别是、、。
(3)写出A、F的结构简式:A____;F。
(4)写出C→D反应的化学方程式:。
[选修物质结构与性质]
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式,F元素原子的电子排布式,E元素的原子结构示意图是。
(2)化合物乙中含有的化学键是。
(3)化合物甲为固体时属于晶体,E单质在一定条件下与甲反应的化学方程式为 。
。
(4)如图立方体中心的“·”表示B单质所形成的原子晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的B原子
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+O2(g)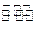 2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正)v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将(填“增大”、“减小”或“不变”)。
2S03(g)△H3=mkJ/mol,平衡常数(K)的大小与温度(T)的关系如右图中曲线所示,则m____0(填“>”“=”或“<”);b点时v(正)v(逆)(填“<”、“=”或“>”)。反应的焓变(△H)将(填“增大”、“减小”或“不变”)。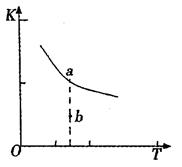
(2)若反应物起始的物质的量相同,下列关系图不正确的是(填序号)。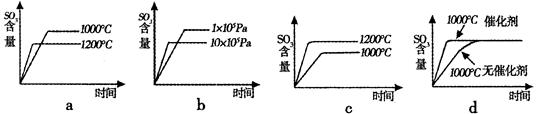
(3)某硫酸厂利用SO2尾气、废铁屑、空气、水合成绿矾(FeS04·7H2O),反应中作还原剂的物质是。
(4)将反应后的混合气体用氨水吸收可得到(NH4)2SO3和(NH4)2SO4两种化工原料。
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO2-3)十c(HSO-3)+c(H2SO3)]=c(NH+4)+c(NH3·H2O)
请分析该同学的依据是。
②在(NH4)2 SO4溶液中存在:NH+4+ H2O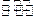 NH3·H2O+H+,则该反应常温下的平衡常数K=(已知:常温下,NH3·H2O的电离平衡常数K=1.
NH3·H2O+H+,则该反应常温下的平衡常数K=(已知:常温下,NH3·H2O的电离平衡常数K=1. 7×10-
7×10- 5)
5)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强 (pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)。万一误服了少量BaCO4,应尽快用大量0. 5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(已知25℃时,Ksp(BaSO4)=1×l0-10 ,Ksp
(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)。万一误服了少量BaCO4,应尽快用大量0. 5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(已知25℃时,Ksp(BaSO4)=1×l0-10 ,Ksp (BaCO3)=1×10-9).
(BaCO3)=1×10-9).