用10mol/L 浓硫酸配制50 ml 1.0mol/L稀硫酸,若实验仪器有:
A.25mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为 mL。
(2)实验时选用的仪器有(填序号) 。
(3)在容量瓶使用方法中,下列操作正确的是(填序号) 。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将准确量取的10mol/L的硫酸,注入已盛有20mL水的50mL的容量瓶中,加水至刻度线
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 未冷却至室温就注入容量瓶中定容
B. 容量瓶用蒸馏洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时仰视溶液的凹液面
仔细阅读下图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。请按要求回答:
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14。A强热分解的化学反应方程式为▲。
(2)写出反应②在工业生产上的一种用途:▲。
(3)反应③的离子方程式为▲;
反应④的化学方程式为▲。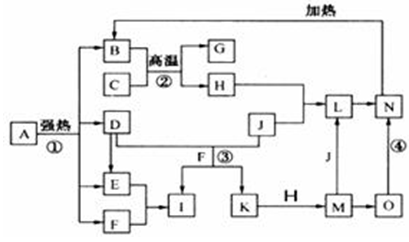
欲用浓硝酸法测定某铜银合金中铜的质量分数(测定反应后生成气体的量),但资料表明:①反应中除生成NO2气体外还有少量NO生成;②常温下NO2和N2O4混合存在,在低于0℃时,几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计了如图所示的实验装置。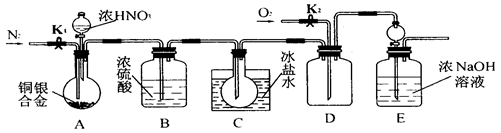
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是__________________________。
(2)装置中B瓶的作用是。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是_____________。
(4)为减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是___________。
(5)C装置烧瓶中的物质是,用简单的实验证实你的判断:。
(6)实验已测出一定质量的铜银合金完全反应后E装置的生成物中含氮元素的质量,为确定合金中铜的质量分数还需测定的数据是______________________。
利用下图装置采用适当试剂可完成实验某探究实验,并得出相应实验结论,实验所用试剂或所得结论列于表中。请回答: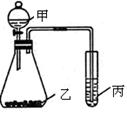
| 实验试剂 |
实验结论 |
||
| 甲 |
乙 |
丙 |
|
| ① |
高锰酸钾 |
② |
氧化性:KMnO4>Cl2>Br2 |
 (1)图中①为,②为。
(1)图中①为,②为。 (2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;(不允许再验证氧化性顺序)
(2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;(不允许再验证氧化性顺序)
| 试剂甲 |
试剂乙 |
试剂丙 |
丙中现象 |
实验结论 |
从海水中可以获得淡水、食盐,并可提取镁和溴等物质;其中海水淡化的常用方法主要有(填一种)。
从海水中提取溴和镁的流程如下图所示: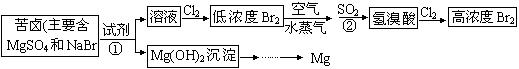
(1)提取Br2时第一次通入Cl2后发生反应的离子方程式是;反应中②中SO2表现出___(填“氧化”或“还原”)性;
第二次通入Cl2后,要提取Br2还要进行的操作为]
(2)为了实现对镁离子的富集,①中加入的足量试剂是 _____ (填化学式);
试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼的方法是(填字母)。
A.Mg(OH)2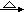 MgO MgO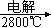 Mg Mg |
B.Mg(OH)2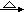 MgO MgO Mg Mg |
C.Mg(OH)2 无水MgCl2 无水MgCl2 Mg Mg |
D.Mg(OH)2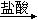 MgCl2溶液 MgCl2溶液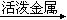 Mg Mg |
利用下图进行浓硫酸与铜反应,并验证二氧化硫的性质。
实验操作如下:连接仪器和安放药品,用酒精灯加热1分钟后撤去酒精灯,将铜丝伸入液面以下,一段时间后拉起铜丝。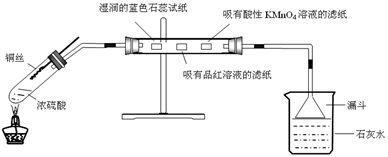
请回答下列问题:
(1)将反应后的试管充分静置,观察到试管底部有白色固体出现,中间层是浅黄色液体(浓硫酸),上层是蓝色溶液。白色固体的化学式为,上述现象中体现了浓硫酸的性质有(填序号)
①酸性②强氧化性③吸水性④脱水性
(2)直玻璃管中依次观察到的现象是:;
;。
(3)某次实验中小烧杯中澄清石灰水始终未观察到浑浊,你猜想可能的原因是,请设计实验证明它。
(4)某学生发现,常温下将铜片长时间放入浓硫酸的试管中并密封,最终生成黑色物质(Cu2S)和蓝色溶液,无气体生成,写出此条件下铜片与浓硫酸反应的化学方程式:。