某实验小组用图A完成课本实验"碳酸氢钠与盐酸反应的探究"后,他们发现两种反应物的用量不同时反应后溶液中的成分也可能不同,于是他们对碳酸氢钠与盐酸反应后的大试管中溶液的成分进行探究,请回答以下问题:

A B C
(1)写出图A中大试管发生反应的化学方程式:
写出小试管中发生反应的化学方程式:
(2)若实验室制二氧化碳应选装置
【提出假设】小组成员认为A中大试管的溶液的溶质只能存在三种情况:
假设1.
假设2.两溶液完全反应后,盐酸过量,溶质为
和
;
假设3. 两溶液完全反应后,
【设计并进行实验和得出结论】小组同学讨论后发现只要用反应物本身两种试剂(碳酸氢钠溶液和稀盐酸)就可以完成实验,请填写下表中的实验内容:
| 实验 |
实验操作 |
实验现象 |
实验结论 |
| ① | 取反应后的溶液少量于试管1中,加入过量的 |
有 |
溶液中存在 假设 |
| ② | 取反应后的溶液少量于试管2中,加入过量的 |
有 |
溶液中存在 假设 |
| ③ | 综合实验①和实验②两个实验操作,发现都没有明显的实验现象 |
溶液中只存在NaCl,假设1成立 |
如图是某种薯片的包装袋,里面被一种气体充得鼓鼓的.小明对这种气体产生了兴趣,
请你和小明一起对该气体进行探究.
【提出问题】该气体可能是什么呢?
【查阅资料】食品和氧气接触容易被氧化而腐败;常填充某种气体以防腐.
【作出假设】包装袋中的气体一定不能是_________________
| A.二氧化碳 | B.氮气 | C.空气 | D.氧气 |
【进行实验】同学们进行了进一步探究,请你帮该组同学完善探究过程,具体操作如下:
| 实验方法 |
可能观察到的现象和结论 |
| 用注射器抽取包装袋的气体,并将气体注入_______________________中,观察现象。 |
_________________________,说明包装袋中装的不是二氧化碳。 |
| 用排水法继续收集一瓶该包装袋内的气体,并向集气瓶中伸入燃着的小木条,观察现象。 |
_______________,说明包装袋中的气体可能是__________。 |
【反思讨论】根据食品防腐气体应具备的要求,你认为包装袋内充的气体还可以是_________。
小明同学选择“影响过氧化氢溶液制取氧气的因素”的课题开展探究。下列是他探究实验数据记录,
| 实验序号 |
反应温度/℃ |
催化剂二氧化锰的用量/g |
过氧化氢溶液的浓度 |
反应所需的时间/分钟 |
| 1 |
15 |
0 |
5% |
30 |
| 2 |
15 |
1g |
5% |
10 |
| 3 |
25 |
1g |
10% |
5 |
| 4 |
25 |
1g |
15% |
3 |
| 5 |
35 |
1g |
15% |
1 |
(1)过氧化氢溶液制取氧气的文字或符号表达式为 ;
(2)实验 和 (填序号),说明二氧化锰能加快过氧化氢溶液分解放出氧气的速度;
(3)对比实验3和4,可得出的结论是 ;
(4)通过对比实验得到影响过氧化氢溶液制取氧气速度的因素有 。
A.溶液的温度B.溶液的浓度C.催化剂的种类
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式 。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律。我 (“同意”或“不同意”)小明的观点,因为 。
(3)小红按右图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
| 实验操作 |
实验现象及结论[ |
| |
(4)为了证明镁可在氮气中燃烧生成氮化镁,小红又设计了如下方案进行验证。
步骤①:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置;另准备一只有一根铜丝穿过的橡皮塞,铜丝末端固定一根镁条。
步骤②:引燃燃烧匙中足量的红磷,塞好橡皮塞;待充分冷却,观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的 左右。
步骤③:往水槽中加水使广口瓶内外水面相平;点燃镁条,迅速更换橡皮塞,镁条在广口瓶内继续燃烧,放出热量;待冷却后广口瓶内水位继续上升。
A.步骤②的目的是 。写出红磷在氧气中燃烧的化学方程式
B.在步骤③“待冷却后广口瓶内水位继续上升”是由于瓶内气压 (选填“大于” “小于”或“等于”)外界气压
C.写出镁在氮气中燃烧生成氮化镁的化学方程式
【反思与交流】
(5)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却大于Mg3N2。请给出合理的解释 。
在对蜡烛及其燃烧进行了探究以后,请你填写下列空格: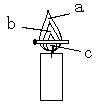
(1)取一支蜡烛,用小刀切下一小块,把它放入水中,蜡烛会 。结论:石蜡的密度比水 。
(2)点燃蜡烛,观察到蜡烛的火焰分为三层,分别是 、 、 。把一根火柴梗放在蜡烛的火焰上(如右图),约1取出,可以看到在 处(填字母)的火柴梗的最先碳化。结论:蜡烛火焰的 温度最高。
(3)在探究蜡烛燃烧的过程中发现罩在火焰上方的烧杯内壁被熏黑,以下做法不合适是( )
| A.反复实验,并观察是否有相同现象 |
| B.查找资料,了解蜡烛的主要成分,探究生成的黑色固体是什么 |
| C.认为与本次实验无关,不予理睬 |
| D.询问老师或同学,讨论生成黑色物质的原因 |
(4)芳芳认为蜡烛燃烧过程中既有化学变化,也有物理变化,而婷婷认为只有化学变化,你同意_______的观点,理由是_________________
实验是科学探究的重要方法。如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题(提示:铜和氧气反应生成黑色固体氧化铜)。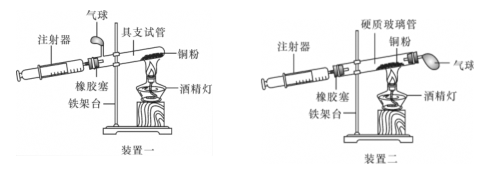
(1)根据下表提供的实验数据,完成下表:
| 硬质玻璃管中 空气的体积 |
反应前注射器 中空气体积 |
反应后注射器 中气体体积 |
实验测得空气中氧气的体积分数 |
| 25mL |
15mL |
9mL |
_____________ |
(2)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条)__________________,__________________。
(3)装置一和装置二中气球的位置不同,____________(填“装置一”或“装置二”)更合理,理由是____________________。