某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体的中心,试回答:
(1)晶体中每个Y同时吸引着 个X,每个X同时吸引着 个Y,该晶体的化学式为 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有 个。
(3)晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为 (填角的度数)。
(4)若该晶体的摩尔质量为M g·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的X中心间的距离为 cm。
化学将对人类解决资源问题作出重大贡献。
乙基香草醛( )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。
(1)写出乙基香草醛分子中的含氧官能团的名称:醛基、 ;
(2)乙基香草醛不能发生下列反应中的 (填序号);
①氧化②还原③加成④取代⑤消去⑥显色⑦加聚
(3)乙基香草醛有多种同分异构体,写出符合下列条件乙基香草醛所有同分异构体的结构简式 ;
①属于酯类
②能与新制氢氧化铜加热后反应生成红色沉淀
③苯环上有两个处于对位的取代基,其中一个是羟基
(4)尼泊金乙酯是乙基香草醛的一种同分异构体,可通过以下过程进行合成: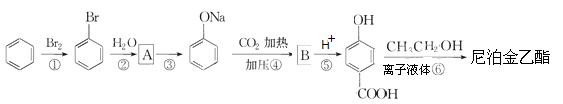
(a)写出A和B的结构简式:A ,B ;
(b)写出第⑥歩反应的化学方程式 。
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。
已知:
请写出NO与CO反应生成无污染气体的热化学方程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0. 20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温”、“降温”)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极反应式为 ,
当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 mol。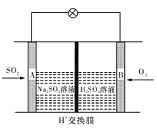
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。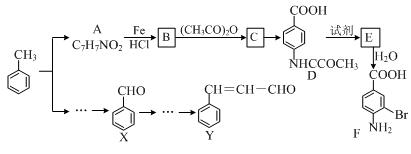
已知:①


②2CH3CHO  CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
(1)下列有关F的说法正确的是 。
| A.分子式是C7H7NO2Br |
| B.能形成内盐 |
| C.能发生取代反应和缩聚反应 |
| D.1 mol的 F最多可以和2 mol NaOH反应 |
(2)C→ D的反应类型是 。
(3)B→C的化学方程式是 。
在合成F的过程中,B→C步骤不能省略,理由是 。
(4)D→E反应所需的试剂是 。
(5)写出同时符合下列条件的A的同分异构体的结构简式 (写出3个)。
①苯环上只有两种不同化学环境的氢原子
②分子中含有 -CHO
(6)以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO CH3COOH
CH3COOH CH3COOCH2CH3
CH3COOCH2CH3
卤代烃在碱性醇溶液中能发生消去反应。例如:
下图是八种有机化合物的转换关系。
请回答下列问题:
(1)上述框图中,属于消去反应的是 (填序号).
(2)①是________ ______ (填反应类型),
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:
___________________________________________________。
(4)C2的结构简式是__________________ 。
F1的结构简式是________________ 。
F1和F2互为________________。
(5)上述八种化合物中,属于二烯烃的是________。
二烯烃的通式是________ 。
合成高分子材料用途广泛、性能优异,其功能与分子结构有密切的关系。下面是几种高分子材料的结构简式:
(1)A是天然橡胶的主要成分,易老化,A中含有的官能团的名称是____________。
(2)B的单体是苯酚和X,这两种单体在碱催化下,可得到网状高分子化合物,俗称电木,是(填“热塑性”或“热固性”)_________塑料,写出X与足量新制的Cu(OH)2悬浊液反应的化学方程式:
(3)C与NaOH溶液在一定条件下反应,生成高吸水性树脂,该树脂的结构简式是___________________________________。
(4)D是合成纤维中目前产量第一的聚酯纤维——涤纶,可由两种单体在一定条件下合成,则这两种单体的化学式是为___________________,______________________。