(9分) (1)下列反应能设计成化学能转化为电能的装置是
A Zn+CuSO4=ZnSO4+Cu B NaOH+HCl=NaCl+H2O
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式:
正极反应 负极反应 .
(3)某烷烃的蒸气质量是相同条件下氢气质量的36倍,该烃的分子式为____________,请写出该烃同分异构体中有4种不同沸点的一氯代物的该烃的结构简式,并命名:
、
A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象: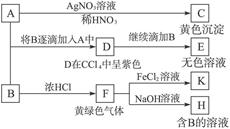
请完成下列问题:
(1)写出A、B和C的化学式:A_____________,B_____________,C_____________。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:______________________________________,_______________________________________。
(3)将SO2气体通入D溶液,D溶液变为无色,生成两种酸。写出反应的离子方程式:______________________________________________________________________________。
(4)写出由F→H的化学方程式:__________________________________________________。
有A、B、C、D、E、F、G 7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显变化。
| A |
B |
C |
D |
E |
F |
G |
|
| A |
- |
- |
- |
- |
- |
- |
↓ |
| B |
- |
- |
- |
- |
↓ |
↓ |
↓ |
| C |
- |
- |
- |
↓ |
- |
↓ |
↓ |
| D |
- |
- |
↓ |
- |
↓ |
↓ |
↓ |
| E |
- |
↓ |
- |
↓ |
- |
↓ |
- |
| F |
- |
↓ |
↓ |
↓ |
↓ |
- |
↓ |
| G |
↓ |
↓ |
↓ |
↓ |
- |
↓ |
- |
试完成下列问题。
(1)A的化学式是_____________,G的化学式是_____________。判断理由是
_______________。
(2)写出其余几种物质的化学式。B: _____________,C: _____________,D: _____________,E: _____________,F: _____________
今有下列两组物质,每组中都有一种物质跟其他三种属于不同的种类。将此种物质和分类依据(选出的物质与其他物质不同之处)写在下面相应的表格内。两组物质分别为:
(1)NaCl、BaCO3、AgNO3、蔗糖
(2)BaSO4、K2CO3、Na2CO3、(NH4)2CO3
| 组别 |
被选出的物质 |
分类依据 |
| 第(1)组 |
||
| 第(2)组 |
一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。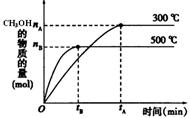
(1)该反应的平衡常数表达式K=;根据右图,升高温度,K值将(填“增大”、“减小”或“不变”)。
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是(填字母)。
a. v生成(CH3OH)= v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变d. CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(填字母)。
a.c(H2)减少 b正反应速率加快,逆反应速率减慢
c. CH3OH的物质的量增加d.重新平衡时c(H2)/ c(CH3OH)减小
下表是元素周期表的一部分,表中所列字母分别代表短周期中的一种元素:
| A |
B |
||||||
| C |
D |
(1)A单质电子式是;B元素在周期表中的位置是。
(2)D单质与C的最高价氧化物对应水化物反应的离子方程式是。
(3)A的气态氢化物与其最高价氧化物对应水化物反应所得产物的名称是,该产物对水的电离起促进作用的原因是。