(1)阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程(略)。
①写出制备阿司匹林的化学方程式 。
可用重结晶提纯法提纯阿司匹林。方法如下:
加热回流的装置如图所示:
②使用温度计的目的是 。
③冷凝水的流进方向是 。(填“b”或“c”)。
④重结晶提纯法所得产品的有机杂质较少的原因 。
检验产品中是否含有水杨酸的化学方法是 。
(2)氯化苄(C6H5CH2Cl)也是一种重要的有机化工原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品(含甲苯)进行纯度检测。每一组检测按照如下步骤进行:
| A.称取0.300 g样品。 |
| B.将样品与25 mL 4 mol·L-lNaOH溶液在三颈烧瓶中混合,水浴加热回流l小时后停止加热(发生的反应为:C6H5CH2Cl+NaOH→C6H5CH2OH+ NaCl)。 |
| C.在三颈烧瓶中加入50 mL 2 mol·L-l HNO3,混合均匀。 |
| D.将三颈烧瓶中溶液全部转移到100 mL容量瓶中,加水定容。 |
E.从容量瓶中取出25.00 mL溶液于锥形瓶中,加入6.00 mL 0.100 mol·L-1AgNO3溶液,振荡混合均匀。
F.在锥形瓶中滴入几滴NH4Fe(SO4)2溶液作为指示剂,用0.0250 mol·L-1 NH4SCN溶液滴定剩余的AgNO3。
G.重复E、F步骤三次,消耗0.0250 mol·L1NH4SCN溶液的平均值为4.00mL。
(已知:NH4SCN+ AgNO3= AgSCN↓+NH4NO3)根据以上实验信息回答下列相关问题:
①C步骤所加硝酸的目的是 。
②在F步骤操作中,判断达到滴定终点的现象是 。
③该产品的纯度为 。(请保留2位小数)
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001 mol·L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液。反应的离子方程式是2MnO4-+5HSO3-+H+]2Mn2++5SO42-+3H2O。填空回答问题:
(1)该滴定实验所需仪器为下列中的__________。
| A.酸式滴定管(50 mL) | B.碱式滴定管(50 mL) |
| C.量筒(10 mL) | D.锥形瓶 E.铁架台 F.滴定管夹 |
G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因:________________________________________________________________________
________________________________________________________________________。
(3)选何种指示剂,说明理由
________________________________________________________________________
________________________________________________________________________。
(4)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40 mL 6 mol·L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。将B、C重复上面的实验。
(1)锌镀层完全反应的标志是
________________________________________________________________________。
(2)如何检验铁片已经洗净
________________________________________________________________________
________________________________________________________________________。
(3)该小组的实验数据记录及数据处理如下,完成下列表格。(锌的密度为7.14 g/cm3)
| 数据记录 |
数据处理 |
|||||
| 镀锌铁皮 |
长度/cm |
宽度/cm |
镀锌铁皮质量/g |
铁皮质量/g |
锌镀层厚度(单侧)/cm |
锌镀层平均厚度(单侧)/cm |
| A |
5.00 |
4.90 |
4.460 |
4.313 |
4.201×10-4 |
|
| B |
5.10 |
5.00 |
4.421 |
4.267 |
4.229×10-4 |
|
| C |
5.20 |
5.00 |
4.640 |
4.467 |
4.660×10-4 |
计算镀锌铁皮锌镀层平均厚度(单侧)________cm。本实验中产生误差的地方可能有哪些(任意列举两
种)________________________________________________________________________
________________________________________________________________________、
________________________________________________________________________。
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O===[Zn(OH)4]2-+H2↑。某同学按下图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6 mol·L-1 NaOH溶液中。回答下列问题。
(4)装置中导管a的作用是
________________________________________________________________________
________________________________________________________________________。
(5)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。上述操作的顺序是
____________________________________________________(填序号)。
(6)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(实验条件下的气体摩尔体积为Vm L·mol-1)。则镀锌铁皮的厚度为
________________________________________________________cm。(写出数学表达式)
塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂。反应原理为: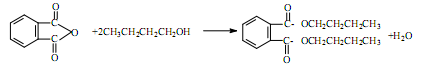
实验步骤如下:
步骤1:在三颈瓶中放入14.8g邻苯二甲酸酐、25mL正丁醇、4滴浓硫酸,开动搅拌器b(反应装置如图)。
步骤2:缓缓加热至邻苯二甲酸酐固体消失,升温至沸腾。
步骤3:等酯化到一定程度时,升温至150℃
步骤4:冷却,将三颈瓶中的液体倒入分漏斗中,用饱和食盐水和5%碳酸钠洗涤。
步骤5:减压蒸馏,收集200~210℃2666Pa馏分,即得DBP产品
(1)浓硫酸的作用,搅拌器的作用。
(2)反应过程中正丁醇过量的目的是。
(3)图中仪器a的名称是分水器,试分析它的作用是。
步骤3中确定有大量酯生成的依据是。
(4)碳酸钠溶液洗涤的目的是。
用减压蒸馏的目的是。
(5)写出正丁醇在135℃生成醚的反应方程式。
写出DBP在氢氧化钠溶液中水解的方程式。
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验。按右表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象。
| 实验 |
P2O5 |
95%乙醇量 |
加热方式 |
| 实验1 |
2g |
4mL |
酒精灯 |
| 实验2 |
2g |
4mL |
水浴70℃ |
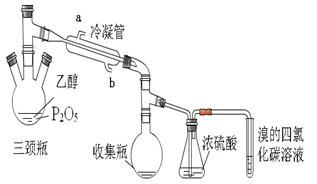
实验结果如下:
| 实验 |
实验现象 |
||
| 三颈瓶 |
收集瓶 |
试管 |
|
| 实验1 |
酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体。 |
有无色液体 |
溶液褪色 |
| 实验2 |
酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 |
有无色液体 |
溶液不褪色 |
根据上述资料,完成下列填空。
(1)写出乙醇制乙烯的化学方程式。
(2)上图装置中冷凝管的作用是___________,进水口为(填“a”或“b”)______,浓硫酸的作用是。
(3)实验1使溴的四氯化碳溶液褪色的物质是___________。
(4)实验2中,水浴加热所需仪器有、(加热、夹持仪器、石棉网除外)。
(5)三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式
_____________________,P2O5在实验1中的作用是______________________ 。
(6)根据实验1、2可以推断:
①以P2O5作为催化剂获得乙烯的反应条件是____________
②P2O5与95%乙醇在加热条件下可以发生的有机反应的类型是________反应。
实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定上述混合气体中含有乙烯和SO2。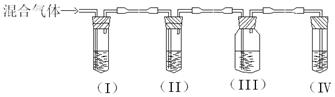
I、II、III、IV装置可盛放的试剂是:I:II:III:
IV:(请将下列有关试剂的序号填入空格内)
| A.品红 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是;
使用装置II的目的是;
使用装置III的目的是;
确定含有乙烯的现象是。