某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
I、实验方案
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,测得的pH逐渐变小直到pH小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
⑴反应后,所得溶液显 性(填“酸”、“碱”或“中”)
⑵用pH试纸测定NaOH溶液pH时,正确的操作是:
。
⑶简述强调“测得的pH小于7”的理由:
______________________________________________________________________________。
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10 克混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
| 编号 |
盐酸 |
NaOH溶液 |
△t/℃ |
| 1 |
3.65﹪ |
2.00﹪ |
3.5 |
| 2 |
3.65﹪ |
4.00﹪ |
x |
| 3 |
7.30﹪ |
8.00﹪ |
14 |
⑷表中x = 。
⑸某同学在没使用温度计的情况下,通过下图所示装置完成了实验。则该同学根据实验现象:
,判断NaOH溶液与稀盐酸发生了中和反应。
II、实验中的意外情况
在实验过程中,他们发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;②可能是Na2CO3;③可能是NaOH和Na2CO3。
⑹小明同学取白色粉末少许,溶于水后,先向溶液中加入足量的 溶液,看到白色沉淀产生,然后向上层清液中加入酚酞试液,看到溶液呈红色,验证了猜想③是正确的。
⑺为了进一步研究,三位同学取了10.0g上述样品,利用电子天平共同做了下图所示的实验。

实验数据记录如下:
| 称 量 项 目 |
称 量 时间 |
质量(g) |
| 试样 |
|
10.00 |
| 装置+稀硫酸质量 |
|
241.20 |
| 装置+稀硫酸质量+试样 |
反应开始后15秒 |
249.20 |
| 装置+稀硫酸质量+试样 |
反应开始后35秒 |
247.00 |
| 装置+稀硫酸质量+试样 |
反应开始后55秒 |
247.00 |
试通过分析表中数据计算上述样品中各成份的质量分数分别是多少?(写出计算过程)。
(8)有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是(实验操作均正确): 。
小明对铁的锈蚀进行如下探究.室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图.观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当装置温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录的反应起始和结束量筒的读数以及所需时间如下表.
| 序号 |
样品 |
量筒起始读数/mL |
量筒最终读数/mL |
所需时间/min |
| ① |
1g铁粉、0.2g碳和10滴水 |
100 |
70 |
约120 |
| ② |
1g铁粉、0.2g碳、10滴水和少量NaCl |
100 |
70 |
约70 |
| ③ |
- |
- |
- |
(1)实验①和②说明NaCl可以________(填“加快”或“减慢”)铁锈蚀的速率.
(2)实验开始后,广口瓶内温度有所上升,说明铁锈蚀的过程是________(填“放热”或“吸热”)过程.
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质主要成分的化学式是________.
(4)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成.
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积分数是________%(保留3位有效数字).
(6)现仅提供:量筒、大烧杯、玻璃棒、水、滤纸包(内含1g铁粉、0.2g碳、10滴水和少量NaCl),请你帮助小明再设计一个测量空气中氧气体积分数的实验方案,在下图框中画出实验装置示意图即可(注明滤纸包的位置).
炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见下图:
对实验进行分析并回答下列问题:
(1)给玻璃管加热的仪器叫酒精喷灯,要用其________(填“外焰”“内焰”或“焰心”)进行加热.
(2)实验中玻璃管里固体粉末的颜色变化是________________________,观察到澄清石灰水的现象是________________________________.
(3)实验前“通入CO”与“开始加热”的先后顺序是________________________________________;实验后“停止通入CO”与“停止加热”的先后顺序是________________________________.
(4)实验要在装置末端a处放置一盏燃着的酒精灯,其作用是________________________________.
小琴同学设计了图所示的A、B两个实验.
(1)实验时,她为了除去铁丝和银丝表面的氧化物或污物,其操作是________________.
(2)A实验的目的是________________________;实验时,将铁丝和银丝同时插入稀硫酸中,可观察到的现象是________________________________________________________;所发生反应的化学方程式为________________________________________.
(3)B实验中,当烧杯内盛有________溶液时,可验证Fe、________________、Ag三种金属的活动性强弱.
铝、铜、铁是日常生活中常见的金属。某化学兴趣小组的同学在探究铝、铜、铁三中金属的有关性质时,进行了如下实验:在A实验中发生反应的化学方程式为___________________________.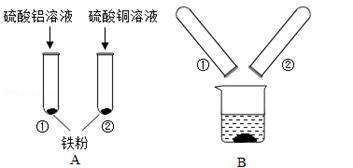
将A实验结束后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,一段时间后过滤,滤渣中:
一定含有的物质是__________,可能含有的物质是__________.为了进一步确定可能有的物质是否存在,同学们向滤渣中滴加稀盐酸,结果没有气泡产生,那么滤液中含有的金属离子可能是____________(填写序号)。
① ②
② 、
、 ③
③ 、
、 ④
④ 、
、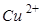
⑤ 、
、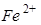 、
、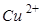
已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上.请设计实验探究该粉末中铁、铜的存在.
资料在线:铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(2Al+2H2O+2NaOH=2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应.
可供选择的实验用品:烧杯、大试管、量筒、滴管、燃烧匙、药匙、磁铁;稀硫酸、稀盐酸、NaOH溶液、氨水.
请你参与并完成以下实验探究过程:
Ⅰ.提出假设
假设1:该混合金属粉末中除铝外还含有Fe.
假设2:该混合金属粉末中除铝外还含有________________________.
假设3:该混合金属粉末中除铝外还含有Fe、Cu.
Ⅱ.设计并实施实验方案
(1)基于假设1,不用化学试剂,证明金属铁的存在的方法是________________________.
(2)基于假设2,将混合金属粉末加入足量稀盐酸中,你观察到的现象是________________________,反应的化学方程式为________________________.
(3)基于假设3,请你完成实验操作,描述实验现象.
| 实验 步骤 |
实验操作(说明仪器和试剂) |
实验 现象 |
结论 |
| ① |
仅除去铝 |
||
| ② |
证明含有铁并除去铁 |
||
| ③ |
将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 |
剩余固体呈紫红色 |
证明含有铜 |